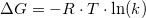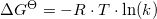Kemi
Termodynamik
Jeg har fået følgende spørgsmål, som jeg simpelthen ikke fatter:
Ag^+(aq)+2NH_3 <->Ag(NH_3)_2^+(aq)
Dannelsen af den komplekse forbindelse er en ligevægt. Redegør for hvordan ligevægtskonstanten kan findes ud fra termodynamiske data.
Umiddelbart tænker jeg, at jeg skal bruge Van't Hoffs ligning, og sætte G lig 0 da det er en ligevægt.
Men ved ikke, hvordan jeg skal komme videre.
Nogle der kan give en hjælpende hånd?
Svar #2
05. maj 2014 af Chrewe (Slettet)
Mange tak for hjælpen mathon. Men hvis delteG er 0, -R er -8.314 og T er 298.15, ender k så ikke med at blive 1 uanset hvad?
Svar #3
05. maj 2014 af OliverGlue
En reversibel(ligevægt) proces er ikke kendt ved deltaG=0, derimod er deltaG=0 for en reversibel proces, når den er nået i ligevægt.
Svar #4
05. maj 2014 af Chrewe (Slettet)
Tak fordi du gider at hjælpe, Oliver! Jeg beklager min uvidenhed, men hvad vil det sige?
Svar #6
05. maj 2014 af Chrewe (Slettet)
Mathon, jeg ved hvordan van't hoffs formel lyder. Men jeg ved ikke, hvordan jeg skal bruge den. Kan du hjælpe?
Svar #7
05. maj 2014 af Chrewe (Slettet)
Mathon, hvorfor besvarer du indlæggene, når du alligevel ikke er interesseret i at hjælpe?
Skriv et svar til: Termodynamik
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.