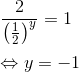Kemi
Reaktionskinetik
Svar #1
07. oktober 2014 af paaske1 (Slettet)
Svar #2
07. oktober 2014 af Heptan
a.
Bemærk følgende sætning: "Det viste sig, at de kolber, der fik tilsat en dobbelt koncentration, var renset på en fjerdedel af den tid, som det tog de andre kolber.
Løs ligningen 2x = 4 for at finde ud af hvilken orden der er tale om, mht. iodid.
Næste sætning: "(...) halvt så meget som de andre. (...) halve tid.
Løs ligningen 0,5y = 0,5 for at finde ud af hvilken orden der er tale om, mht. jern(III)
Svar #4
07. oktober 2014 af paaske1 (Slettet)
Mange tak!
- men hvorfor skal man netop løse liningen 2x = 4 i spm. a?
Svar #6
07. oktober 2014 af Heptan
opløser??
Forestil dig at koncentrationen af iodid er "1", og at reaktionshastigheden er "1". Forestil dig nu at vi fordobler koncentration af iodid. Nu er den "2". Hvad sker der med reaktionshastigheden? Vi får at vide at den firdobles, dvs.
v = k * [Fe3+]y * [I-]x
"4" = k * [Fe3+]y * ("2")x
Da k * [[Fe3+]y er konstant i "tankeeksperimentet", kan vi se bort fra det, og tilbage har vi:
"4" = ("2")x
Dvs. x = 2
Jeg håber du forstår
Svar #7
07. oktober 2014 af paaske1 (Slettet)
Hov, der skulle have stået opløfter istedet for opl?øser.
Men, hvor får man at vide, at reaktionen firdobles? Man får da kun at vide, at kolberne blev renset på en fjerdedel af den tid, som det tog de andre kolber.
Svar #9
08. oktober 2014 af paaske1 (Slettet)
Undskyls jeg mener, hvor få man at vide at reaktions hastigheden fridobles?
Svar #10
08. oktober 2014 af paaske1 (Slettet)
*Undskyld, jeg mener, hvor får man at vide at reaktionshastigheden fridobles?
Svar #11
09. oktober 2014 af Heptan
Se #2
At der bruges en fjerdedel af tiden, betyder at reaktionshastigheden er firdoblet, dvs. at reaktionen er gået 4 gange så hurtigt
Svar #12
09. oktober 2014 af paaske1 (Slettet)
Min lærer jern(III)altså Fe3+ er en 0. oden. Det passer da ikke med 0,5y = 0,5
Svar #14
09. oktober 2014 af Sneharusha (Slettet)
Tror din lærer har ret. Er selv en elev, mens synes det gover mest mening, hvid Fe3+ har en 0.orden.
Forstår ikke helt, hvorfor @Heptan vil have at man skal løse ligningen 0,5y=0,5. Men som sagt er jeg en elev, så jeg ved det ikke helt.
Svar #15
10. oktober 2014 af Heptan
Min fejl, jeg antydede jo selv at reaktionshastigheden firdobles når der bruges en fjerdedel af tiden, og tilsvarende vil reaktionshastigheden selvfølgelig fordobles når der bruges den halve tid. Dvs
0,5y = 2
y = -1
Ovenstående forudsætter at formuleringen "angrebet, cirka halvt så meget som de andre" betyder "koncentrationen af jern(III) i en kolbe er det halve ifht. en anden kolbe"
Det kan også være at jeg har fortolket teksten forkert.
Lad os forestille os at reaktionen er af 0. orden mht. Fe3+. Dvs. reaktionen afhænger slet ikke af koncentrationen af jern(III). Selvom vi fordobler koncentrationen eller halverer den eller whatever. Reaktionshastigheden er konstant, hvis [I-] er konstant, selvom [Fe3+] ændrer sig. Det er hvad det betyder at reaktionen er af 0. orden mht. Fe3+. Men i teksten står der altså at reaktionen går dobbelt så hurtigt, når [Fe3+] halveres. Er det ikke mærkeligt ?
Skriv et svar til: Reaktionskinetik
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


![v=k \cdot [Fe^{3+}]^y \cdot [I^-]^x](https://media.studieportalen.dk/images/equations/96RF8450Z4j3DHVHGJQwTA==.gif)
![[I^-]](https://media.studieportalen.dk/images/equations/0VYx4iX4m4dG-qJ_4eat-Q==.gif) er konstant,
er konstant, ![k_1=k \cdot [I^-]](https://media.studieportalen.dk/images/equations/MHV9wqsNMVKyKfxtCuIfDA==.gif) , dvs.
, dvs.![v = k_1 \cdot [Fe^{3+}]^y](https://media.studieportalen.dk/images/equations/lOzya1FP2GvfLjhiMxGS2Q==.gif)
![\ \\\\\ \newline \\\\\\\\\\\\\\\ \ \ \ 2 \cdot v = k_1 \cdot \left (\frac{1}{2} \cdot [Fe^{3+}] \right )^y \newline](https://media.studieportalen.dk/images/equations/xUHTopFgsY2gVtjQcoHsTQ==.gif)
![\Leftrightarrow 2\cdot v=k_1 \cdot \left (\frac{1}{2} \right )^y \cdot [Fe^{3+}]^y \newline](https://media.studieportalen.dk/images/equations/KkvPQYI4uvPmgUR10fBE7A==.gif)
![\Leftrightarrow \frac{2}{\left (\frac{1}{2} \right )^y} \cdot v=k_1 \cdot [Fe^{3+}]^y](https://media.studieportalen.dk/images/equations/pJY6omN2gwWCQyWyELAKZA==.gif)