Kemi
reaktionshastigheder
Hej, er der nogle, som gerne vil hjælpe mig med denne opgave?

Har selv prøvet lidt:
a'eren: Jeg bruger excel, hvor jeg plotter 1/[OH-] som funktion af tiden, hvis reaktionen giver en ret linje er det en 2. ordens reaktion.
b'eren: Da det er en 2. ordens reaktion siger jeg t0,5=1/(k*[OH-]0) hvor k og [OH-] aflæses ved en regressione af en retlinje fra opgave a.
c'eren: Denne opgave har jeg vandskligheder med.
d'eren: Skal jeg benytte forskriften fra regression hvor jeg løser 1/[OH-](50) ?
Svar #1
28. oktober 2014 af Sneharusha (Slettet)
Jeg har problemer med a'eren, da jeg ikke kan vise at det er en anden ordens reaktion. Jeg har prøvet af plotte det ind i excel, hvor
1.orden: R2=0,99779
2.orden: R2=0,96331
Det giver ikke så meget mening, da R2 er tættere på 1 i første ordens reaktionen.
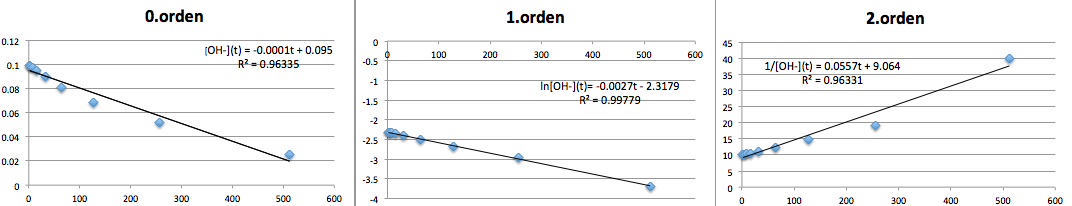
Er der nogle, som gerne vil hjælpe? :)
Svar #2
28. oktober 2014 af OliverGlue
Hvordan udregner du 1/[OH-]?
På din graf har det sidste punkt en værdi på omkring 40(du har udregnet 1/0,025), men burde være 1/0,035=28,6.
Jeg får en regression på y=0,0362x + 10,009 med en R2=0,9999.
Svar #3
28. oktober 2014 af OliverGlue
c.
![\dfrac{1}{[\mathrm{A}]}=\dfrac{1}{[\mathrm{A}_{0}]}+k\cdot t\Rightarrow\dfrac{1}{0,02}=\dfrac{1}{0,1}+0,0362\cdot t\Leftrightarrow t=\dfrac{40}{0,0362}=1105\mathrm{s}](https://media.studieportalen.dk/images/equations/dZQTLwJH1iXUNqtxB8z6mg==.gif)
d.
Find koncentrationen med samme fremgandsmåde som c. og benyt
![v=k\cdot[\mathrm{A]^{2}}](https://media.studieportalen.dk/images/equations/3w7yuS5FLVaVdPRZF9Y7Pw==.gif)
Svar #4
29. oktober 2014 af Sneharusha (Slettet)
Men i c'eren skal man så ikke bruge formlen for halveringstiden ved en 2.ordens reaktion? Altså:
![t_0_,_5 =\frac{1}{k*[A]_0}](https://media.studieportalen.dk/images/equations/DvhfxqlvmpCEYhZBWicOyw==.gif)
Svar #5
29. oktober 2014 af OliverGlue
#4
Nej
Halveringstiden har ikke noget at gøre med koncentrationen 0,02?
Se evt. http://isisa.systime.dk/index.php?id=886
Svar #6
29. oktober 2014 af Sneharusha (Slettet)
Gud, ja det er da mig der læser forkert. Jeg beklager. Men er det ikke rigtigt at det er denne formlel man skal benytte, hvis det er en anden ordens reaktion? - Skal jeg bruge funktionen fra regressionen?
Svar #8
29. oktober 2014 af Heptan
Ja, du skal bruge formlen for halveringstiden i b'eren, som du har skrevet
![t_{1/2} =\frac{1}{k \cdot [OH^-]_0}](https://media.studieportalen.dk/images/equations/wJmkZYg0zHcI7EFWuJO_8A==.gif)
og indsæt k.
Det er noget sludder at sige "beregn halveringstiden", da den varierer. Halveringstiden er ikke konstant.
Men du kan jo beregne den ift. startkoncentrationen på 0,1 M.
Der gælder således, at
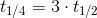
og
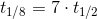
Skriv et svar til: reaktionshastigheder
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

