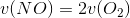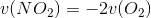Kemi
Reaktionshastighed
Hej SP
Jeg har denne reaktion: 2 NO (g) + O2 (g) ? 2 NO2 (g)
Og så har jeg også de vedlagte kurver
Jeg skal så forklare hvorfor det er vigtigt at nævne hvilken af reaktionsdeltagerne hastighederne er baseret på. Er det fordi hastigheden for NO og NO2 er den samme, imens den ene faktisk bliver mindre og den anden mere? Og det ser man jo ikke hvis kun man ser på hastigheden? Er det derfor? Eller har jeg misforstået det?
Og så skal jeg bare lige også høre: Enheden for hastigheden i grafen, den er M/min, ikke?
Mvh
Svar #3
01. februar 2015 af cecilied34 (Slettet)
Kan I ikke prøve at uddybe det lidt, jeg er nemlig ikke helt med?
Skriv et svar til: Reaktionshastighed
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


![v(NO)=-\frac{\mathrm{d}\left [ NO \right ] }{\mathrm{d} t}](https://media.studieportalen.dk/images/equations/imGRs0qJsE_XHhWtOAFLSA==.gif)
![v(O_2)=-\frac{\mathrm{d}\left [ O_2 \right ] }{\mathrm{d} t}](https://media.studieportalen.dk/images/equations/0m4Oet8lrtGcyawjDyS2Iw==.gif)
![v(NO_2)=\frac{\mathrm{d}\left [ NO_2 \right ] }{\mathrm{d} t}](https://media.studieportalen.dk/images/equations/l0Pgg-pfhdWMqqEVPSNuYw==.gif)