Kemi
Reaktionsskema
Hvordan opskriver jeg reaktionsskemaet for Al2(SO4)3 i vand?
Mit bud er:
Al2(SO4)3 (aq)+12H2O(l) ---> [Al(6H2O)]3+(aq)+ 3H2SO4(aq)
Er dette korrekt?
Svar #1
18. oktober 2015 af Heptan
Al2(SO4)3 (s) → 2 Al3+(aq) + 3 SO42-(aq)
Al3+ findes i virkeligheden i vandig opløsning på formen [Al(OH2)6]3+ lidt ligesom du har skrevet. Jeg har skrevet O til venstre for H for at vise at det er O der binder til Al.
Det viser sig at [Al(OH2)6]3+, ligesom mange andre metaller, er en syre:
[Al(OH2)6]3+(aq) → [AlOH(OH2)5]2+(aq) + H+(aq)
Svar #2
18. oktober 2015 af Lillyn
Er reaktionsskemaet for Al2(SO4)3 i vand så: Al2(SO4)3 (s) → 2 Al3+(aq) + 3 SO42-(aq) ?
Skal der ikke ske om kompleksdannelse?
Jeg skal herefter beregne koncentrationen af [Al(OH2)6]3+ i 0,1 M opløsning af Al2(SO4)3, skal jeg så opstille en ligevægt og gøre det ud derfra?
Svar #3
18. oktober 2015 af LeonhardEuler
Al2(SO4)3 + 6 H2O → 2 Al(OH)3 + 3 H2SO4
Selvom jeg har placeret en ensrettet pil, så skal det naturligvis forståes som en dobbel harpun, men for dit vedkommende beregn på:
Al2(SO4)3 → 2 Al3+ + 3 SO42-
Find da opløselighedsproduktet.
Svar #4
18. oktober 2015 af Lillyn
#3 Med 2 Al(OH)3 mener du så komplekset [Al(OH2)6]3+?
opløselighedsproduktet er
Ksp=[Al3+]2[SO42-]3
Idet koncentrationen er 0,1 M opløsning af Al2(SO4)3, kan det så passe at:
[Al3+]=0,2M
[SO42-]=0,3M
Er det korrekt?
Svar #5
18. oktober 2015 af Heptan
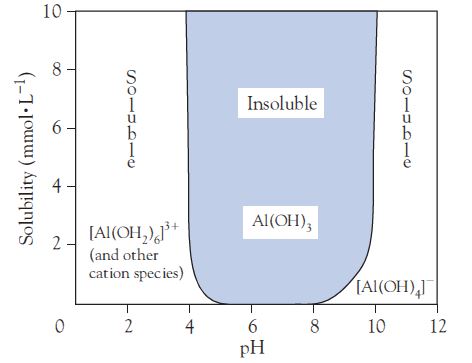
#4 Nej, Al(OH)3 er det bundfald der kommer i en opløsning af Al3+, hvis pH er ca. 7. Men vi sagde jo at Al3+ er en syre, og dens styrke er sammenlignelig med ethansyre. Det er derfor aluminiumsulfat er opløselig i vand. Da Al3+ er en svag syre kan du antage at koncentrationen af [Al(OH2)6]3+ er 0,2 M. [SO42-] er også med god tilnærmelse 0,3 M, selvom det er en meget svag base.
Tilsætter man lidt base til opløsningen vil der fælde Al(OH)3. Hvis man tilsætter overskud af base, vil bundfaldet opløses igen, fordi der dannes komplekset [Al(OH)4]- som er opløseligt. Vi siger at Al3+ er amfoter, altså både en syre og en base.
Svar #6
18. oktober 2015 af Lillyn
Jeg beklager meget, men jeg er blevet lidt forvirret nu. Hvad er reaktionsskemaet for Al2(SO4)3 i vand? Er det et af følgende:
Al2(SO4)3 (s) → 2 Al3+(aq) + 3 SO42-(aq)
[Al(OH2)6]3+(aq) → [AlOH(OH2)5]2+(aq) + H+(aq)
Al2(SO4)3 + 6 H2O → 2 Al(OH)3 + 3 H2SO4
Svar #7
18. oktober 2015 af Heptan
#6 Det er den øverste. Nr. 2 er desuden en af flere ligevægte i opløsningen.
Svar #8
18. oktober 2015 af Lillyn
Okay, nu er jeg med igen, så ved at kigge på reaktionsskemaet for Al2(SO4)3 i vand:
Al2(SO4)3 (s) ⇔ 2 Al3+(aq) + 3 SO42-(aq) (er dette en ligevægt, eller bliver af aluminiumsulfaten dissocieret?)
Opløselighedsproduktet er:
Ksp=[Al3+]2[SO42-]3
Jeg skal herefter beregne koncentrationen af [Al(OH2)6]3+ i 0,1 M opløsning af Al2(SO4)3, skal jeg opstille denne ligevægt, idet Al3+ er en svag syre, som reagere med vand:
Al3+(aq) + 6H2O(l) → [Al(OH2)6]3+ (aq)
Skal jeg dernæst bestemme koncentrationen af hhv. Al3+ og SO42- beregnes, og dette gøres således:
Al2(SO4)3 (s) ⇔ 2 Al3+(aq) + 3 SO42-(aq)
Start: 0,1M 0 0
Ligevægt: 0,1M-0,1M 2*0,2M 3*0,1M
Er jeg på rette vej?
Svar #9
18. oktober 2015 af Lillyn
Jeg har arbejdet med denne opgave i et stykke tid, og jeg må indrømme, at jeg er på bar bund, jeg ved ikke, hvordan jeg skal komme videre.
Svar #10
18. oktober 2015 af Heptan
#8 Det er en ligevægt, hvis der er 'bundfald'.
Det er en rigtig god fremgangsmåde du har gang i. Under 2 Al3+ skal der stå 2*0,1M og ikke 2*0,2M.
Du har antaget at ligevægten er forskudt helt mod højre, og det er en god antagelse fordi ionforbindelsen er letopløselig.
Svar #11
18. oktober 2015 af Lillyn
Okay, jeg prøver at arbejde videre med dette, og vender tilbage når jeg har et svar. :)
Svar #12
18. oktober 2015 af Lillyn
For aluminiumsulfat i vand forløber flg. ligevægt:
Al2(SO4)3 (s) ⇔ 2 Al3+(aq) + 3 SO42-(aq)
Start: 0,1M 0 0
Ligevægt: 0,1M-0,1M 2*0,1M 3*0,1M
Ligevægt: 0 0,2 M 0,3M
Idet Al3+ er en svag syre, reagerer den med vandet, hvorved der dannes komplekset [Al(OH2)6]3+ i flg. ligevægt:
Al3+(aq) + H2O(l) ⇔ [Al(OH2)6]3+ (aq)
Start: 0,2M 0
Ligevægt: 0,2M-x x
[Al(OH2)6]3+ har en pKa-værdi på 4,58, koncentrationen af [Al(OH2)6]3+ kan findes ved at opstille ligevægtskonstanten:
10-4,58=x/(0,2-x)
x=0,000005
Dvs. koncentrationen af [Al(OH2)6]3+ er 0,000005M, er dette rigtigt? Det føles forkert.
Svar #13
18. oktober 2015 af Heptan
#12
Jeg tror du har misforstået syre/base reaktionen ... den er nemlig
[Al(OH2)6]3+(aq) 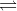 [AlOH(OH2)5]2+(aq) + H+(aq) syre/base reaktion
[AlOH(OH2)5]2+(aq) + H+(aq) syre/base reaktion
Den reaktion du har skrevet er en såkaldt hydratiseringsreaktion ... husk, at der overfører hydroner i en syre/base reaktion.
Al3+(aq) + 6 H2O(l) → [Al(OH2)6]3+ (aq) hydratiseringsreaktion
Den sker fuldstændigt, så jeg har tegnet en reaktionspil, →.
Svar #14
18. oktober 2015 af Heptan
[Al(OH2)6]3+(aq) 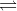 [AlOH(OH2)5]2+(aq) + H+(aq)
[AlOH(OH2)5]2+(aq) + H+(aq)
Start: 0,2M 0 0
Ligevægt: 0,2M-x x x
Svar #15
18. oktober 2015 af Lillyn
Okay, jeg tror, at jeg er med, jeg har lige et spørgsmål: Er det ud fra hydratiseringsreaktionen, at man kan se at Al3+ og [Al(OH2)6]3+ reagerer i forholdet 1:1, og derved har de sammen koncentration?
Svar #17
19. oktober 2015 af Lillyn
Jeg troede, at jeg havde løst opgaven, men nu er jeg kommet i tvivl på et andet område. Reaktionsskemaet for aluminiumsulfat i vand er:
Al2(SO4)3 ⇔ 2 Al3+(aq) + 3 SO42-(aq)
Hvor jeg ved at kigge på ligevægten har bestemt koncentrationen af 2 Al3+ til 0,2 M #12. For hydratiseringsreaktionen, burde den så ikke være:
2 Al3+ (aq) + 12H2O (aq) ⇔2[Al(OH2)6]3+ (aq)
Jeg kan godt se, at Al3+ og [Al(OH2)6]3+ reagerer i forholdet 1:1, men har 2 Al3+ som 1 Al3+?
Svar #18
19. oktober 2015 af Lillyn
Kan dette passe:
Al2(SO4)3 (s) ⇔ 2 Al3+(aq) + 3 SO42-(aq)
Start: 0,1M 0 0
Ligevægt: 0,1M-0,1M 2*0,1M 3*0,1M
Ligevægt: 0 0,2 M 0,3M
Hvis det er en ligevægt, så vil koncentrationen af aluminiumsulfat vel ikke være 0?
Svar #19
19. oktober 2015 af Heptan
#17 Det er den samme reaktion, du kan bare dividere reaktionsskemaet med 2, så er forholdet 1:6:1 igen.
#18 Det hele bliver opløst, så det er ikke en ligevægt.




