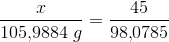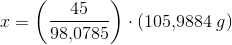Kemi
forsøg: natriumcarbonat vs svovlsyre
Hey dudes, håber i kan hjælpe mig med denne opgave. jeg har siddet med den i lang tid, unden held.
Ved en fejl spildes 45g svovlsyre på bordet. Syren neuraliseres med natriumcarbonat.
H2SO4 + Na2 CO3 --> Na2SO4 + CO2 + CO2
hvor meget vejer det natriumcarbonat, som skal bruges til at neutraliserer det spildte svovlsyre?
Svar #1
31. oktober 2015 af mathon
ækvivalente H2SO4 + Na2CO3  Na2SO4 + CO2 + H2O
Na2SO4 + CO2 + H2O
stofmængder 1 mol 1 mol
masser 98,0785 g 105,9884 g
45 g x
Svar #3
31. oktober 2015 af Heptan
Brug formlen
m = nM
hvor m er massen, n er stofmængden og M er den molare masse.
Svar #4
31. oktober 2015 af runekonge (Slettet)
skal jeg så gange dem eller?
forstår virkelig ikke denne opgave :-D
Skriv et svar til: forsøg: natriumcarbonat vs svovlsyre
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.