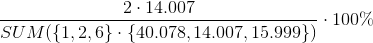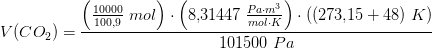Kemi
Kemi-aflevering
Kalksalpater, Ca(NO3)2 anvendes til gødning af fx græsplæner
a) Hvor mange masse% N indeholder kalsalpeter=
Kalksalpeter fremstilles ved at behandle kalk, CaCO3, med salpetersyre:
CaCO3 (s) + 2HNO3 (aq) --> Ca(NO3)2 (s) + CO2 (g) + H2O (l)
b) Beregn massen af HNO3, der teoretisk skal bruges til fremstilling af 10 kg kalksalpeter.
c) Beregn volumenet af den mængde CO2 (g), der afgives ved fremstillingen, idet temperaturen er 48 grader celsius, og trykket er 1,015 bar. A
Håber der er nogen som kan hjælpe
Svar #2
08. december 2015 af mathon
b)
CaCO3 (s) + 2 HNO3 (aq) --> Ca(NO3)2 (s) + CO2 (g) + H2O (l)
ækvivalente mængder 1 mol 2 mol 1 mol
100,09 g 126,04 g 1 mol
10000 g x y
forholdsberegning:
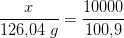
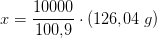
c)
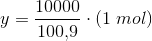
Svar #5
09. december 2015 af LubDub
b) Beregn massen af HNO3, der teoretisk skal bruges til fremstilling af 10 kg kalksalpeter.
CaCO3 + 2 HNO3 -----> Ca(NO3)2 + CO2 + H2O
n(Ca(NO3)2) = (1·104 g) / (164,0878 g/mol) = 60,94298296 mol
n(HNO3) = 2 • n(Ca(NO3)2) = 2 • 60,94298296 mol = 121,8859659 mol
m(HNO3) = (121,8859659 mol) • (63,0128 g/mol) = 7680,375992 g ≈ 7680 g ≈ 7,7 kg
Svar #6
09. december 2015 af mathon
Sorry!
b)
Ca(NO3)2 (s) + 2 HNO3 (aq) --> Ca(NO3)2 (s) + CO2 (g) + H2O (l)
ækvivalente mængder 1 mol 2 mol 1 mol
164,10 g 126,04 g 1 mol
10000 g x y
forholdsberegning:
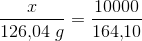
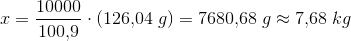
c)
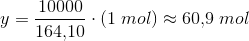
Svar #8
09. december 2015 af mathon
b) …det går/gik sgu godt i dag/i går :-)
CaCO3 (s) + 2 HNO3 (aq) --> Ca(NO3)2 (s) + CO2 (g) + H2O (l)
ækvivalente mængder 2 mol 1 mol 1 mol
126,04 g 164,10 g 1 mol
x 10000 g y
forholdsberegning:
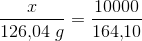
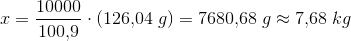
c)
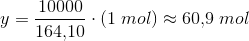
Svar #9
25. maj 2020 af Weeke (Slettet)
# 8 Vil man i opgave c) ikke benytte sig af idealgasligningen, da man skal udregne volumenet, fordi man har alle oplysningerne til at kunne benytte sig af formlen?
Skriv et svar til: Kemi-aflevering
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.