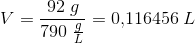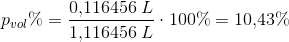Kemi
Alkoholer
En druemost af chardonay-druer, der anvendes til fremstilling af hvidvine i Bourgogne-området indeholder 180 g glucose pr. liter.
Hvor meget ethanol dannes der under gæringen?
Hvor mange liter carbondioxid dannes der?
Beregn masse% af ethanol i slutopløsningen.
Beregn vol% af ethanol i slutopløsningen, idet det antages, at slutrumfanget er lig med rumfanget af den dannede alkohol plus rumfanget af den oprindelige mængde vand.
Svar #1
26. januar 2016 af mathon
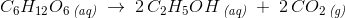
ækvivalentmængder: 1 mol 2 mol 2 mol
180 g 92 g 88 g
Du oplyser ikke gæringstemperatur og lufttryk.
Svar #3
27. januar 2016 af aeondude
Kan du så prøve en gang til den videre fremgangsmåde?
Har stadig brug for hjælp.
Hilsner
Svar #4
27. januar 2016 af aeondude
Samme med det her:
Hvor mange liter carbondioxid (20 °C og 101 kPa) er der opløst i en flaske champagne? Ved 6 gange atmosfæretrykket er opløseligheden af carbondioxid 0,20 M.
?
Svar #5
28. januar 2016 af mathon
Hvor mange liter carbondioxid dannes der?
Indsæt i idealgasligningen:
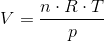
Svar #7
28. januar 2016 af mathon
Massen af ren alkohol i 1 L chardonay-druer
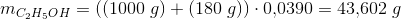
Ren alkohols densitet er 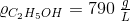
Volumen af ren alkohol i 1 L chardonay-druer
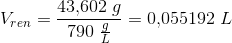
Volumenprocent:
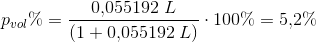
Svar #8
28. januar 2016 af aeondude
#5Hvor mange liter carbondioxid dannes der?
Indsæt i idealgasligningen:
Men passer det her så at; n = 1 mol ? nøjagtig?...fordi det tal jeg udregner (3,9328) er ikke det facit, som jeg har liggende i en facitliste(som jeg ofte bruger til kontrol for facitterne).
Svar #10
28. januar 2016 af aeondude
Hej, det ser også korrekte ud, jeg har selv prøvetat regne mig frem til det hele, men igen passer facitten ikke...
Det skal være 3,6 L
Har også allerede kontakteret min lærer, venter på respons...
Svar #12
28. januar 2016 af lasols (Slettet)
jeg får altså de 3.6L har i husket at en champagneflaske ikke er på 10L men på 0,75L så stofmængden af opløst CO2 bliver 0.75L*0,2M=0.15 mol som så indsættes i idealgasloven
Skriv et svar til: Alkoholer
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




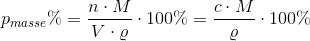
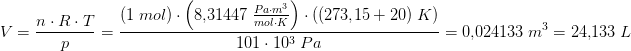
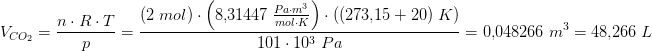
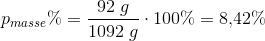 CO2'en er boblet væk.
CO2'en er boblet væk.