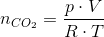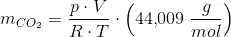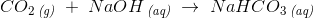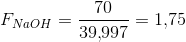Kemi
Kemi! haster
Bjarne skal udregne noget natriumhydrogencarbonat. Børge har lovet at hjælpe med at fremstille det. natriumhydrogencarbonat fremstilles hjælp af 2 reaktioner.
Reakton 1: CO2+2NaOH->Na2CO3+H2O
Reaktion 2: Na2CO3+CO2+H2O->2NaHCO3
Børge har 35 liter CO2(101kPa og 20 grader celcius) og 70 g NaOH
A. Beregn hvor meget Na2CO2 Børge kan fremstille.
B. Hvilken reaktant er den begrænsende faktor
C. Hvad skal Børge tilsætte for at ækvivalente mængder af reaktanerne.
Svar #2
15. februar 2016 af Muddisimsek (Slettet)
#1Brug idealgasligningen
på formen:
og masseberegningen:
Forstår det seriøst ikke -.-
Svar #3
15. februar 2016 af mathon
Børge har 35 L CO2 ved 101 kPa og 20°C
hvoraf antal mol CO2 kan beregnes.
Dernæst beregnes massen af det beregnede atal mol CO2.
mol-forhold:
CO2 : NaOH = 1 : 2
Svar #5
15. februar 2016 af Muddisimsek (Slettet)
#3Børge har 35 L CO2 ved 101 kPa og 20°C
hvoraf antal mol CO2 kan beregnes.
Dernæst beregnes massen af det beregnede atal mol CO2.mol-forhold:
CO2 : NaOH = 1 : 2
Hvad med opgave B?
Svar #6
15. februar 2016 af mathon
B)
ækvivalenter: 1 mol 2 mol
44,009 g 79,994 g
aktuelle mængder: 63,83 g 70 g
forholdsfaktorer:
Hvoraf det ses, at de 70 g NaOH er i underskud i forhold til 63,83 g CO2.
Svar #7
15. februar 2016 af Soeffi
#0 Bjarne skal udregne noget natriumhydrogencarbonat. Børge har lovet at hjælpe med at fremstille det. natriumhydrogencarbonat fremstilles hjælp af 2 reaktioner.Reakton 1: CO2+2NaOH->Na2CO3+H2O
Reaktion 2: Na2CO3+CO2+H2O->2NaHCO3
Børge har 35 liter CO2(101kPa og 20 grader celcius) og 70 g NaOH
A. Beregn hvor meget Na2CO2 Børge kan fremstille.
B. Hvilken reaktant er den begrænsende faktor
C. Hvad skal Børge tilsætte for at ækvivalente mængder af reaktanerne.
Opgaven taler dels om natriumhydrogencarbonat, dvs. NaHCO3 som slutprodukt, dels om Na2CO3. Hvis man antager, at der spørges efter det første bliver molforholdet 1:1 og CO2 er dermed i underskud.
Skriv et svar til: Kemi! haster
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.