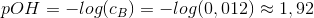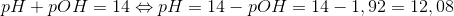Kemi
Kemi syre base
Hej. Jeg har en kemiopgave for til i morgen og har svært ved disse spørgsmål. Det kunne være fantastisk med noget hjælp, måske bare til en enkel hvis man kan. Det ville hjælpe mig SÅ meget!
1) vi vil bestemme, hvor meget eddikesyre (CH3COOH) der er i syltede agurker ved ar titrere med natriumhydroxid-opløsning med phenolphtalein som indikator.
2,0 mL agurkelage overføres med pipette til en lille konisk kolbe. Lidt indikatorpapir tilsættes og med kanylesprøjte tilsættes 0,05 mol/L NaOH
Reaktionen som sker ved titrering er: CH3COOH (aq) + OH- (aq) = CH3COO- (aq) + H2O (l)
a) beregn tilsat stofmængde NaOH
b) vis koncentrationen af CH3COOH i agurkelagen bliver 0,23 mol/L
c) beregn masseprocenten af CH3COOH i agurkelagen, når densiteten af lagen sættes til 1 g/mL og molarmassen for CH3COOH er 60 g/mol
d) ser dit resultat rigtig ud, når der i almindelig husholdningseddike er 5% eddikesyre?
1)
a) beregn pH i 0,012 mol/L HCL (aq)
b) beregn pH i 0,012 mol/L NaOH (aq)
c) beregn [H3O+] i en opløsning med pH = 4,0
d) beregn pH i en blanding af 50mL 0,15 mol/L NaOH (aq) og 100 mL 0,22 mol/L HCL (aq)
(Tip: beregn stofmængder af OH- og H+ og find overskud af en af ionerne. Beregn koncentrationen for den af ionerne der er i overskud. Beregn herefter pH)
Svar #2
08. marts 2016 af studerendeyo (Slettet)
0,92 mL. Det skal lige siges at jeg har regnet stofmængden ud således: n = c * v
n = 0,05mol/L * 0,00092L = 0,00046 M
Svar #3
08. marts 2016 af studerendeyo (Slettet)
Har også regnet b'eren nu (tror jeg) 0,00046 : 0,002 = 0,23. Men resten har jeg virkelig ingen anelse om
Svar #4
08. marts 2016 af Skaljeglavedinelektier
Her er lidt hjælp til anden del:
a) HCl er en stærk syre så brug 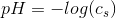
b) NaOH er en stærk base så brug 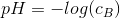
c) Brug at ![pH=-log([H_3O^+])](https://media.studieportalen.dk/images/equations/XTigMPZUJ3CiLySLGg-NOw==.gif)
d) Opgaven giver dig et tip
Svar #6
08. marts 2016 af Skaljeglavedinelektier
Koncentrationen af syren(cS) og koncentrationen af basen(cB).
Svar #7
08. marts 2016 af studerendeyo (Slettet)
Jeg tænkte umiddelbart; -log(0,012) = 1,94, men så ville pH-en jo blive det samme til begge, og det giver jo ikke mening..
Svar #8
08. marts 2016 af Skaljeglavedinelektier
Ja unskyld jeg glemte at skrive et O ind. Du skal bruge: 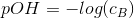 .
.
pH kan du så finde ud fra sammenhængen: 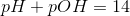
Svar #9
08. marts 2016 af studerendeyo (Slettet)
Jeg tror stadig ikke helt jeg forstår det.. Resultaterne bliver blev stadig det samme?
Svar #14
08. marts 2016 af studerendeyo (Slettet)
Min veninde sagde tidligere at jeg til beregning af H3O skulle bruge formlen:10^-pH mol/L, men det hjælper mig ikke det store..
Svar #15
08. marts 2016 af Skaljeglavedinelektier
Der står sådanne nogle to klammer omkring: [ ]. Du finder altså den aktuelle koncentration af H3O+. Hvis du er i tvivl om udregningen, så kan dit CAS-værktøj løse det ved at opskrive det således: 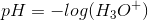 , hvor du blot indsætter din pH-værdi og isolerer.
, hvor du blot indsætter din pH-værdi og isolerer.
Svar #16
08. marts 2016 af Skaljeglavedinelektier
Din venindes formel er det samme, blot hvor [H3O+] er isoleret i den formel, jeg har anvist dig. Jeg ville dog huske på min, da denne ligning er definitionen af pH.
Svar #18
08. marts 2016 af Skaljeglavedinelektier
Din opgaveformulering lyder: beregn [H3O+] i en opløsning med pH = 4,0
Formlen til udregningen er: ![pH=-log([H_3O^+])](https://media.studieportalen.dk/images/equations/XTigMPZUJ3CiLySLGg-NOw==.gif) .
.
Du får opgivet din pH-værdi, men ønsker at finde [H3O+], hvilket netop er det, der står inde i dit -log( ).
![pH=-log([H_3O^+])\Leftrightarrow 4=-log([H_3O^+])\Leftrightarrow [H_3O^+]=1*10^{-4}M](https://media.studieportalen.dk/images/equations/d-k5pwRbm949eggicNZF4w==.gif)