Kemi
mængdeberegning. bestemmelse af indhold i eddikesyrer
Hej!
svarer c i formlen c=n/v til n i formlen m=n*M ?
Jeg har lavet en rapport hvor jeg skulle finde indholdet af eddikesyrer, og jeg bliver nu helt i tvivl, om jeg har gjort noget forkert. Hvis man skal finde indholdet, er det så massen eller koncentrationen? Jeg har gjort således:
Jeg finder først stofmængden af NaOH vha. formlen n= c*V:
n= 0,100 mol/L * 0,01575 L = 0,001575 mol
Da stofferne reagerer i samme forhold 1:1 er stofmængden for OH- og CH3COOH ligeledes 0,01575 mol.
Når stofmængde og volumen af CH3COOH er kendt, kan koncentrationen findes vha formlen c? n/V --> 0,001575 mol/ 0,002 L = 0,7875 mol/L.
Molarmassen beregnes herefter for eddikesyren og vå går: 60,052 g/mol.
Herfra kan massen af eddikesyren (er dette korrekt?) findes:
m= M*n = 0,07875 mol * 60,052 g/mol = 4,729095 g.
MEN! Jeg har jo sat koncentrationen ind i denne formel.... Hvis jeg sætter stofmængden ind, for jeg et helt andet resultat, og det lægger meget langt det det, som jeg egentlig burde få.
på deklerationen står der, at indholdet af eddikesyrer er 5%. ved beregning får jeg:
4,729095/1000g (densiteten) *100% = 4,729%, hvilket jo er meget tæt på den angivne værdi...........
Svar #1
07. august 2016 af Skaljeglavedinelektier
Det er ofte svært at give et godt svar på udregninger til en øvelse/rapport, man ikke kender til.
n angiver dog stofmængden i begge af dine to formler. c er koncentrationen og altså ikke stofmængden.
Svar #2
07. august 2016 af Manu0407 (Slettet)
Ja, det kan jeg selvfølgelig også godt se. Men tak for dit svar!...
Jeg er jo egentlig godt klar over, at n står for stofmængden i begge formler, men jeg kan simpelthen ikke forstå, hvordan jeg kan have regnet som jeg har gjort, for jeg bruger koncentrationen og ikke stofmængden til at finde indholdet af eddikesyren i min sidste beregning, og i min rapport har min lærer intet kommenteret ifht. mine beregninger.
Svar #3
07. august 2016 af BadBoyBard (Slettet)
Manu0407: Det ville være en rigtig stor hjælp, hvis du kunne give data for dit experiment, da vi nemmere kan give dig rådgivning på den måde. Men det lyder, som om, at det er en titreringsanalyse, du laver.
Jeg gætter på, at NaOH er den base, du kender stofmængen på, og din eddikesyre, der er den ubekendte syre, som du skal finde koncentrationen af. Er dette korrekt?
Mht. dit første spørgsmål, så er svaret nej. I denne her formel:
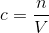
Er c jo blot et udtryk for koncentration, dvs. hvor mange mol af stoffet der findes i en x liter opløsning. I formlen:
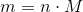
Er n jo et udtryk for stofmængden, hvilket ikke er det samme som koncentrationen, da stofmænge måles i mol, og koncentration måles i mol/liter. Så de er ikke synonyme med hinanden! Den bommert må du endelig ikke lave til en examen.
Mht. din rapport, så er det en fordel at skrive reaktionsskemaet for reaktionen op. Du har jo, at:
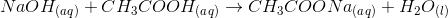
Og her er svaret, ja. Stofferne vil reagere i forholdet 1:1. Eftersom det er NaOH, du bruger som regent til at titrere med, så skal du finde stofmængden af det NaOH, du har brugt. Hvis du har brugt 15.75 mL NaOH, før du kom til ækvivalenspunktet (dvs. der hvor pH værdien skifter fra sur til basisk), så har du ret i, at den tilsvarende stofmængde vil være 0,001575 mol. Den har du regnet rigtig ud på.
Og ja, siden reaktionsforholdet, som jeg angav i reaktionsskemaet er 1:1, så har du helt ret i, at du i ækvivalenspunktet har brugt netop det samme antal mol eddikesyre. Derfor har du 0,001575 mol, så du har også helt ret der.
Du skriver nu, at:
Når stofmængde og volumen af CH3COOH er kendt, kan koncentrationen findes vha formlen c? n/V --> 0,001575 mol/ 0,002 L = 0,7875 mol/L.
Hvad jeg tror, du rent faktisk burde skrive i din rapport, er at:
Eftersom vi allerede kender volumen af eddikesyre (CH3COOH), kan vi beregne koncentrationen i mol/L af eddikesyren via denne formel:
Eftersom det andet, du skrev virker lidt uklart.
Men det er nu en fejl at indsætte koncentrationen istedet for stofmængden ind i m = M*n formlen, da du burde indsætte massen af eddikesyre.
Husk, at procentvis indhold af eddikkesyre er:
%Indhold = (gram Eddikkesyre)/(gram eddikkesyreopløsning)
Har du data på, hvor meget din eddikesyre opløsning vejede? Altså den opløsning, du forsøgte at finde koncentrationen af?
Men jeg synes ellers, at dine data lyder lidt tvivlsomme. Kan det for eksempel passe, at du kun har titreret 2 mL eddikkesyre og ikke 20 mL? For det er det, dine udregninger kommunikerer. Hvis du har titreret 2 mL, så lyder det tvivlsomt, at dette skulle kræve 15.75 mL NaOH før du fik nået ækvivalenspunktet.
Derudover kan jeg heller ikke se, hvorfor du dividerer med 1000, når du skal finde den procentvise indhold af eddikesyre. Der er vel hele flasken, der vejede 1000g, ikke? I denne flaske burde der ikke være det samme gram eddikkesyre opløst, som der er i den 2 mL (20mL) opløsning, du lavede dit experiment på.
Men husk at et forsøg sagtens kan afvige, nogle gange meget, fra virkligheden, da man kunne have lavet fejl undervejs i forsøget. Dette er helt normalt.
Men som #1 siger, så er det svært at give et godt svar på udregninger til en øvelse, vi ikke kender til, men jeg forsøger blot at lave en fejlfinding lige nu, eftersom dine data virker lidt tvivlsomme.
Mvh
B
Svar #4
07. august 2016 af Skaljeglavedinelektier
#3 Giver nogle fine betragtninger. Herunder følger et eksempel, som jeg tror vil passe på din øvelse.
Du har sandsynligvis brugt 25 mL eddikesyre og phenolphtalein som indikator. Du vil sandsynligvis også have fortyndet eddikesyren - jeg gætter på, at det er fortyndet 10 gange. Rekationsskemaet er rigtig nok, som #3 skriver:
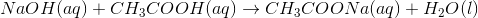
Eddikesyre og NaOH reagerer altså i forholdet 1:1, som reaktionsskemaet viser. Under antagelse af at der ved ækvivalenspunktet er tilsat 22 mL NaOH, vil stofmængden af 0,1 M NaOH være givet ved:
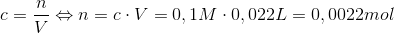
I ækvivalenspunktet gælder der, at 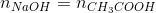 .
.
Koncentrationen af den fortyndede eddikeopløsing kan så findes som:
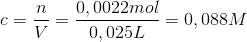
Den ufortyndet eddikesyre er herved 0,88 M, da den er blevet fortyndet 10 gange.
Du kan nu finde massen af eddikkesyre i 1 liter lagereddike:
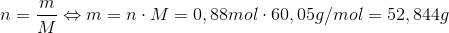
Under antagelse af at 1 liter lagereddike vejer 1 kg, er masseprocenten af lagereddikke:
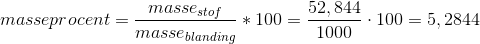 - Der skal selvfølgelig stå procent 3 steder, men det kan jeg ikke få lov til at skrive.
- Der skal selvfølgelig stå procent 3 steder, men det kan jeg ikke få lov til at skrive.
Som du kan se, er 5,2844% et meget pænt tal.
Skriv et svar til: mængdeberegning. bestemmelse af indhold i eddikesyrer
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.