Kemi
Reaktionshastighed opgaver kemi
Hej alle!!
Jeg har dog lige problemer med min næste aflevering... Det er en meget lang aflevering, men sidder fast i nogle af opgaverne :( Håber du kan hjælpe og give gode forklaringer :)
1) Opskriv reaktionshastigheden udtrykt ved ændringen af de indgående stoffers koncentrationer i følgende reaktioner:
a: C6H12O6(aq) -> 2C3H6O3(aq)
b: 2CH3OH(g) + 3O2(g) -> 2CO2(g) + 4H2O(g)
2) Hvad er reaktionsordenen for de følgende reaktioner? (Jeg ved desværre heller ikke hvordan man bestemmer reaktionsorden, kan du forklarer mig kort om det?)
a: 2N2O5(g)--><-- (Pile ovenover hinanden, der går i hver sin retning) 4NO2(g) + O2(g)
v=k*[N2O5]
b: 2NO2(g) --><-- 2NO(g) + O2(g)
v=k*[NO2]2
c: CH3CH2Br(aq) + OH-(aq) --><-- CH3CH2OH(aq) + Br-(aq)
v=k*[CH3CH2Br]*[Br-]
3) Hvordan kan man i princippet måle hastigheden af følgende reaktioner?
a) Dibrom adderer til ethen.
b) Ethylethanoat hydrolyseres i basisk opløsning.
c) Methanol dannes af carbonmonoxid og vanddamp.
d) Iodationer reduceres til iodidioner af sulfitioner.
4) I teksten nævnes disse to reaktioner:
H2(g) + Br2(g) --><-- 2 HBr(g)
v=k*[H2]•[Br2]1/2
2NO(g) + O2(g) --><-- 2NO2(g)
v=k*[NO]2*[O2]
Afgør for hver reaktion:
a) Hvilken reaktant vil bidrage mest til at øge hastigheden, når man øger dens koncentration?
5) Når 50 mL 1 M saltsyre hældes over 5 g pulveriseret calsiumvarbonat, starter der en gasudvikling. Tabellen viser, hvor stort et volumen gas der dannes som funktion af tiden. Temperatur og tryk holdes konstante.
t/min: 0 - 1 - 2 - 3 - 4 - 5 - 6 - 7 - 8
V/mL: 0 - 280 - 420 - 490 - 530 - 550 - 560 - 560 - 560
a) Opskriv reaktionsskemaet for reaktionen mellem saltsyre og calciumcarbonat
b) Tegn en graf, der viser volumenet af den dannede gas som funktion af tiden:
c) Forklar kurvens udseende
d) Hvor er reaktionshastigheden størst?
Mange gange tak på forhånd med de opgaver i kan hjælpe mig med :)
Svar #1
01. februar 2017 af trekdoor (Slettet)
Jeg synes, du skal først komme i gang, og hvis der dukker op lidt mere specific spørgsmål, så kan vi hjælpe.
Det giver jo ikke mening, at du kopirer hele afleveringsseddel og forum skulle svare på alt.
Prøv at starte med f. eks. nr. 5, tegn grafen, laver differentiation og så har du næsten opgaven løst.
T.
Svar #2
01. februar 2017 af 1999hjælp (Slettet)
#1Jeg synes, du skal først komme i gang, og hvis der dukker op lidt mere specific spørgsmål, så kan vi hjælpe.
Det giver jo ikke mening, at du kopirer hele afleveringsseddel og forum skulle svare på alt.
Prøv at starte med f. eks. nr. 5, tegn grafen, laver differentiation og så har du næsten opgaven løst.
T.
Hej... Jeg har lavet alle opgaver undentagen 1 og 2, så hvis de ville hjælpe mig med den, ville det være dejligt :)
Svar #3
01. februar 2017 af trekdoor (Slettet)
1) Hvis du har en reaktion mellem to stoffer A og B de danner C:
a A + b B → c C
er reaktionshastighedens formuleret som det:
r = k(T) *[A]m * [B]n
k er reaktionskonstante og afhængig af temperaturen, [A] er konzentration af stof A, m og n er partielle reaktionsordninger og danner sammen reaktionsorden, det er det du skal angive i opgave 2.
I udtrykket for r bliver oft indsat stochiometrifaktorer a og b som eksponent, men det er ikke rigtigt, m og n bliver bestemt eksperimentelt.
Kunne det hjælpe?
T.
Svar #4
01. februar 2017 af trekdoor (Slettet)
Undskyld: k er reaktionshastighedens konstante.
a og b kunne bruges i ligevægtskonstante for en reaktion.
Svar #5
01. februar 2017 af 1999hjælp (Slettet)
#31) Hvis du har en reaktion mellem to stoffer A og B de danner C:
a A + b B → c C
er reaktionshastighedens formuleret som det:
r = k(T) *[A]m * [B]n
k er reaktionskonstante og afhængig af temperaturen, [A] er konzentration af stof A, m og n er partielle reaktionsordninger og danner sammen reaktionsorden, det er det du skal angive i opgave 2.
I udtrykket for r bliver oft indsat stochiometrifaktorer a og b som eksponent, men det er ikke rigtigt, m og n bliver bestemt eksperimentelt.
Kunne det hjælpe?
T.
Forstår desværre ikke :(
Svar #7
01. februar 2017 af trekdoor (Slettet)
Måske var det lidt forvirrende at jeg brugte 'r' i ligningen i stedet for 'v' fra din opgave.
Så kan du numed hjælp af eksponenterne (his der står ingenting er det = 1) beregne reaktionsordning.
Og så kunne jeg se, at jeg har forstået opgave 1 lidt anderledes.
1) Opskriv reaktionshastigheden udtrykt ved ændringen af de indgående stoffers koncentrationer i følgende reaktioner:
a: C6H12O6(aq) -> 2C3H6O3(aq)
Kunne det ikke tænkes, at løsningen til 1a) er:
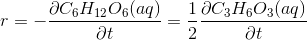
ifølge denne wikipedia side:
https://da.wikipedia.org/wiki/Reaktionshastighed
jeg håber at det bliver nu klarer.
T.
Svar #8
02. februar 2017 af 1999hjælp (Slettet)
Det hjalp mange tak !
Men kan du hjælpe med 2'eren også?
Svar #9
02. februar 2017 af trekdoor (Slettet)
#3....
r = k(T) *[A]m * [B]nk er reaktionskonstante og afhængig af temperaturen, [A] er konzentration af stof A, m og n er partielle reaktionsordninger og danner sammen reaktionsorden, det er det du skal angive i opgave 2..
Det skulle forklar 2), bare opsummer eksponenterne.
Hiilsner T.
Skriv et svar til: Reaktionshastighed opgaver kemi
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






