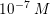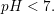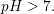Kemi
pH-begrebet
04. juni 2017 af
NannaJan
-
Niveau: C-niveau
Har fået flg. spørgsmål: Hvorfor kan pH-begrebet kun bruges om syre/baser opløst i vand?
Det må vil være noget med, at pH-skalaen angiver om noget er surt/basisk ifht. stofmængekoncentrationerne af H3O+ og OH-. Disse ioner opstår først når en syre/base reagerer med vand. Er det korrekt eller helt ved siden af? Hvordan kunne det ellers formuleres?
Skriv et svar til: pH-begrebet
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


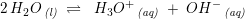
![\small \left [H_3O^+ \right ]\cdot \left [ OH^- \right ]=10^{-14}](https://media.studieportalen.dk/images/equations/BHocMy4epKqK7W3FV8NhjA==.gif)
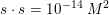
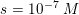
![\small \left [ H_3O^+ \right ]=s=10^{-7}\; M](https://media.studieportalen.dk/images/equations/iTcHyBJ42bcQI6ZA7d-JGA==.gif)
![\small pH=-\log\left (\left [ H_3O^+ \right ] /M \right )=-\log\left (10^{-7} \right )=7](https://media.studieportalen.dk/images/equations/qKImXGjMulMluq_Rg-ghkg==.gif)
![\small \left [ H_3O^+ \right ]](https://media.studieportalen.dk/images/equations/pHGGS4BdCO7tW9J-SE1lgg==.gif) , som derved bliver større end
, som derved bliver større end