Kemi
Bjergrumdiagram
en der ved hvad ækvivalenspunkterne i det vedhæftede bjergrumsdiagram fortæller noget om?
Svar #2
01. juni 2019 af gerthansen
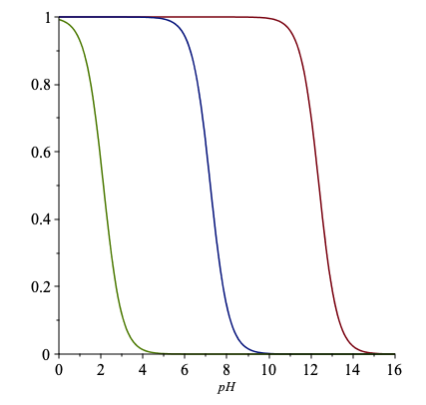
Det kan du til dels godt fortælle, men hvad du mere kan fortælle er pka værdier for de tre ting du har i. Hvor du kan se du har en syre, en neutral, og en base.
Svar #3
01. juni 2019 af mathon
Det oplyser om fordelingen af syre og korresponderende base ved forskellige pH-værdier (syrebrøken kan læses som procent)
- her for en triprot syre.
Svar #5
01. juni 2019 af mathon
...så det er fordelingsgraden af syre og korresponderende base ved forskellige pH-værdier.
Svar #6
01. juni 2019 af Lise123Lise
Tak. Ved du hvordan man skal beregne massen af H_3PO_4? har udregnet M til at være 97,99 g/ml men ved ikke hvordan jeg skal finde frem til stofmængden som ingår i formlen m = n * M?
Svar #7
01. juni 2019 af Lise123Lise
Forsøgsresultater:
Skriv et svar til: Bjergrumdiagram
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.