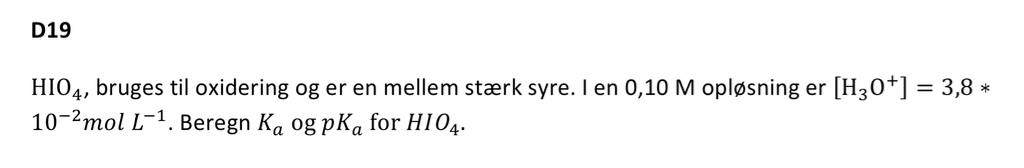Kemi
Syre-base
Jeg har nogle opgaver for til imorgen i Kemi. Og en af dem er (vedhæftet) jeg ved ikke hvordan jeg skal begynde på opgaven.
Håber en kan hjælpe.
Tak på forhånd :)
Svar #1
25. september 2019 af Signekas
Kan man lave et reaktionsskema? Jeg kan bare ikke se hvordan. Men hvis man kunne, ved jeg godt at jeg kan regne min Ka ved at stille det op som en brøk
Svar #4
25. september 2019 af Signekas
Tak! :)
Kan jeg også regne det på denne måde? Jeg får samme svar på denne måde, men hvilken måde er mest rigtig?
Skriv et svar til: Syre-base
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.