Kemi
Oxidation
Hej jeg for at vide at jeg skal opløse 20 mg af (et ukendt salt som indeholder Pb2+ + Fe3+, i få dråber saltsyre 4 M. og derefter tilsætte kaliumiod og 5 dr. dodecan opløsning omrystes og så bliver den organisk fase violet.
Jeg skal så opskrive den afstemte ligning for reaktionen med oxidatinstrin for redox-parret.
Og i forhold til formålet med opgaven er det ikke bare at vise at Pb og Fe har forskellige oxidationstrin?
Svar #1
14. november 2019 af Soeffi
#0. Organisk fase (dodekan) bliver violet betyder, at der dannes I2.
Svar #2
14. november 2019 af hellokitty3
Men hvordan ser reaktionen ud og formålet med forsøger er vel af vise at pb og Fe kan lave forskellie oxidationstal ikke
Svar #3
14. november 2019 af Soeffi
#2. Det er sandsynligvis Fe3+, da den kan oxydere I-. Pb2+ danner bare bundfald.
Svar #5
14. november 2019 af Soeffi
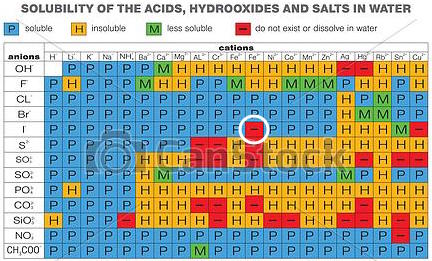
#4.
Ja, dvs: 2Fe3+ + 2I- → 2Fe2+ + I2. Du kan også se det på, at FeI3 ikke kan lade sig gøre jvf. nedenstående tabel:...
Svar #6
15. november 2019 af Buma
Svar #7
15. november 2019 af Buma
Svar #8
15. november 2019 af Soeffi
#7 Men hvad er formålet med forsøget altså hvilken viden om kationers kan udledes af forsøget
At kationen er Fe(III) og ikke Pb(II).
Svar #9
15. november 2019 af hellokitty3
Fordi at pb ikke kan oxideres ikke, men jeg tænker er det fordi at vi får den violette farve
Svar #10
15. november 2019 af Soeffi
#9. Pb(II) + iodid giver hvidt bundfald af PbI2.
Fe(III) + iodid giver Fe(II) og violet organisk fase med I2.
Det fremgår i øvrigt af ovenstående tabel, af Fe(II) ikke danner bundfald med et evt. overskud af I-.
Jeg ved ikke hvilken rolle HCl spiller, men gætter på at evt. tilstedeværelse af OH- kan give uønskede sidereaktioner.
Svar #11
17. november 2019 af heydudig
Men Hvad er oxidationstrinnet for redox-parret og hvordan kan det vises?
Skriv et svar til: Oxidation
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.

