Kemi
Potentiometrisk titrering af ethansyre
Hej derude,
jeg er i gang med at lave en kemi rapport omkring en potentiometrisk titrering af ethansyre. Hertil har vi lavet et forsøg hvor vi har fået data, og ud fra denne data er der blevet lavet noget som ligner en logitisk graf.
BEMÆRK VEDHÆFTEDE
To af de sidste spørgsmål i rapporten lyder som følgende:
7. Slå pKs værdien for ethansyre op i en tabel
- Dette har jeg gjort, og denne er aflæst til 4.76
Næste spørgsmål lyder:
8. Aflæs pKs værdien for ethansyre på titrerkurven:
- Her er jeg lidt i tvivl, jeg formoder stærkt at jeg skal aflæse hvor på grafen 4.76 er?
Det meget simpelt, men jeg skal bare lige sikre mig det.
Fordi den sidste opgave siger nemlig:
Sammenlign den fundne pKs værdi med tabelværdien
- Og dette forstår jeg slet ikke.
P.s. det skal lige siges at titrerkurven er pH som funktion af den tilsatte V(NaOH) i opløsningen
Håber nogle vil hjælpe mig, med et skub videre.
God weekend
Svar #1
26. februar 2021 af louisesørensen2
Er man interesseret i at jeg skal beregne pH-værdien i ækvivalenspunktet?
Svar #3
27. februar 2021 af Soeffi
#1...Er man interesseret i at jeg skal beregne pH-værdien i ækvivalenspunktet?
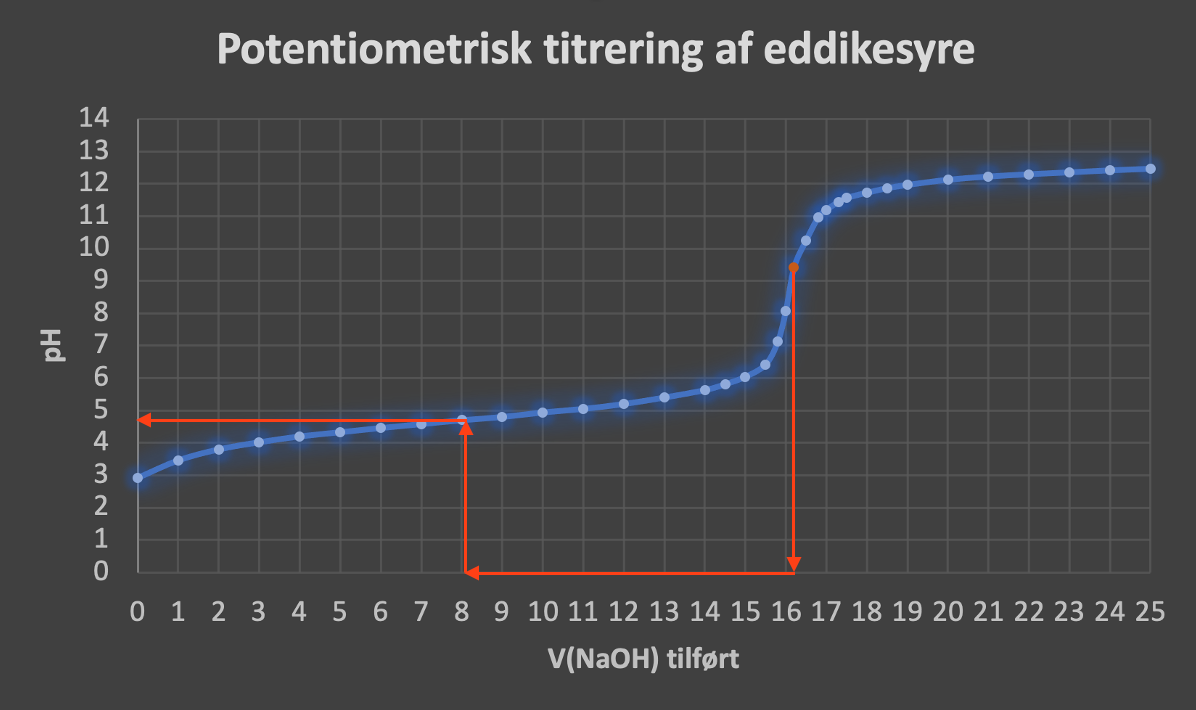
Nej, du skal finde V(NaOH) i ækvivalenspunktet og derudfra pKs som vist:...
Svar #5
25. april 2023 af Hejmeddig12344444
#2pKs er den pH-værdien svarende til den halve titratormængde:
Hej Mathon. Jeg forstår ikke hvad V_0 har med V at gøre, du skriver ligefrem at ved halvt titratorvolumen hedder den åbenbart 1/2 V_0, er det ikke 1/2 V?
Svar #7
25. april 2023 af Hejmeddig12344444
#6Genlæs #2
Findes der egentlig en formel der ligner den samme men bare med koncentrationerne af base og syre indenfor logaritmen?
Skriv et svar til: Potentiometrisk titrering af ethansyre
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


