Kemi
Titrering af NaCl
Hej,
Nogle der kan hjælpe med, hvad man kan tale ud fra de to bilag samt udfylde skemaet eller hvordan man gør?
Svar #1
28. maj 2021 af Heptan
https://www.canterbury.ac.nz/media/documents/science-outreach/chloride_mohr.pdf
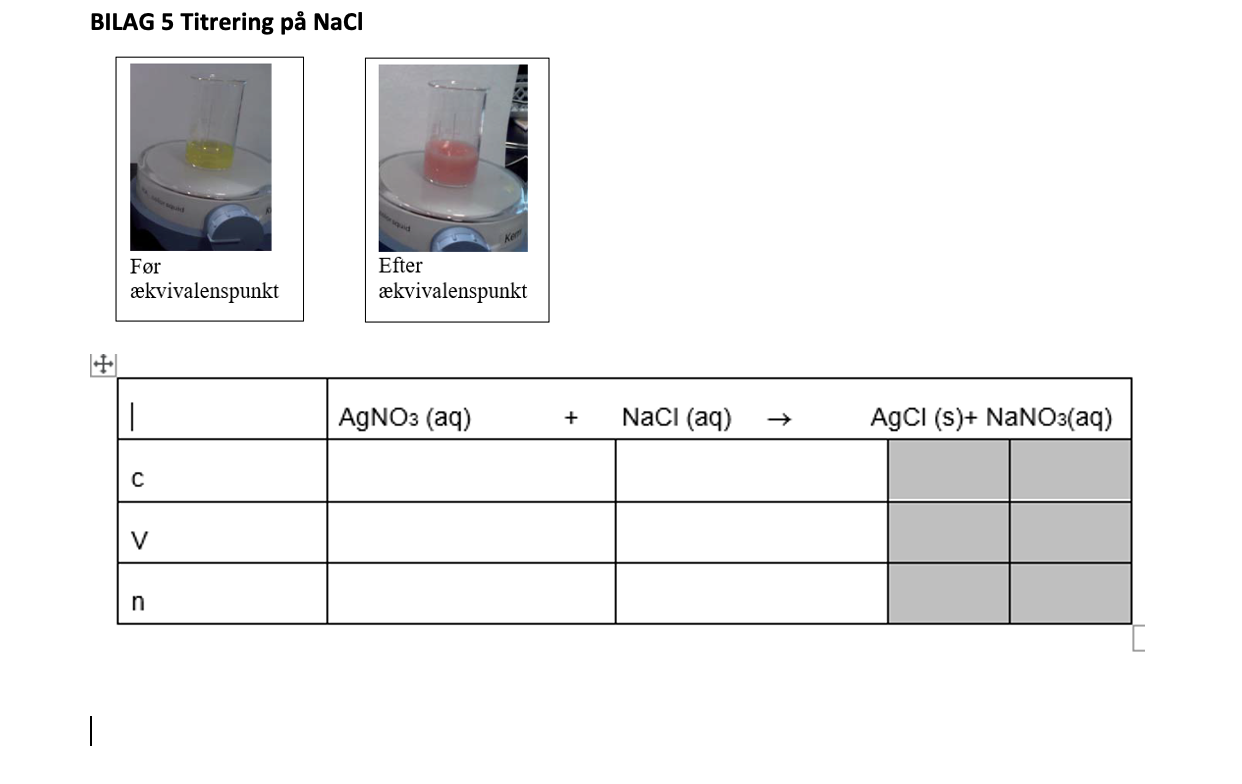
Titrering af NaCl for at bestemme koncentrationen af NaCl i opløsningen. Man bruger kaliumchromat (K2CrO4 (aq)) som indikator, og den har farven gul. Man tilsætter sølv(I)nitrat (AgNO3 (aq)) dråbevist som reagerer med NaCl og danner hvidt bundfald. Når der ikke er mere NaCl tilbage, så reagerer sølvionerne (Ag+(aq)) med indikatoren (CrO42-) og danner et rødt bundfald af Ag2CrO4 (s). Dvs. det gule stof forsvinder, og det røde stof dannes, præcis når der ikke er mere NaCl tilbage.
Så skriver man ned, hvor meget AgNO3 (aq) man brugte, og så kan man regne koncentrationen af NaCl ud med formlen:
c = n/V
Skriv et svar til: Titrering af NaCl
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



