Kemi
Beregn pH
Hej, har brug for hjælp til en "lille" opgave :)
Vi har ligevægten HClO_2(aq)+H_2O(l) <-> ClO_2^-(aq)+H_3O^+(aq)
a) Beregn chlorsyrlings styrkekonstant ved 25 grader celcius ud fra termodynamiske data. =1,058*10^-2 M
I en vandig opløsning af chlorsyrling er den formelle stofmængdekoncentation af chlorsyrling 0,120 M
b) Beregn pH for opløsningen ved 25 grader celcius. =1,38 (Kan det give mening?? pls)
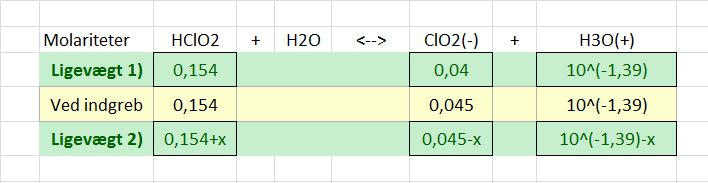
I en anden vandig opløsning af chlorsyrling er koncentrationen af HClO_2 = 0,154 M og koncentrationen af ClO_2 = 0,040 M.
600 mL af denne opløsning tilsættes chlorit, således at koncentrationen af chlorit øges til 0,045 M. Herefter indstiller en ny ligevæft sig. Det kan antages, at opløsningens volumen ikke ændres.
c) Beregn pH for opløsningen ved 25 grader celsius, når den nye ligevægt er indstillet.
Det er spørgsmål c jeg har brug for hjælp til. Er vi ude i en pufferopløsning, hvor jeg skal beregne stofmængder før og efter? Men jeg kender jo ikke andelen af de to...
Tak, det ville betyde meget!
Svar #2
01. november 2014 af OliverGlue
Reaktionen og ligevægtsbrøken er
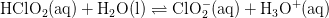
![K_{\mathrm{a}}=\mbox{\ensuremath{\mathrm{\dfrac{[ClO_{2}^{-}][H_{3}O^{+}]}{[HClO_{2}]}}}}](https://media.studieportalen.dk/images/equations/FjIfarWGaRkJgbzA4BGa9Q==.gif)
Startbetingelser indsættes i ligevægtsbrøken
![K_{\mathrm{a}}=\mbox{\ensuremath{\mathrm{\dfrac{[0.045][H_{3}O^{+}]}{[0.154]}}}}](https://media.studieportalen.dk/images/equations/2ujqbQM2M3fAB_YyCDER3Q==.gif)
Opgaven lyder at finde pH altså koncentrationen af hydronium. Vores styrkekonstant er for en syre, altså dannelsen af hydronium, så derfor bliver der brugt en chlorsyrling til dannelsen af produktet(samme fremgangsmåde som for pufferligningen).
![K_{\mathrm{a}}=\mbox{\ensuremath{\mathrm{\dfrac{[0.045+x][x]}{[0.154-x]}\Rightarrow x=0.0212}}}](https://media.studieportalen.dk/images/equations/Mvj7ljIwGMGUAtMW3J7_NQ==.gif)
Svar #3
01. november 2014 af OliverGlue
#0
Hvordan har du beregnet b) ? Jeg får
pH=-log[10]((-1.057*10^(-2)+sqrt((1.057*10^(-2))^2+.120*(4*1.057)*10^(-2)))*(1/2))=1.51
Svar #4
02. november 2014 af Heptan
I b) får jeg også pH = 1,51
c)'eren er svær, fordi vi næsten ikke får noget at vide om opløsningen før tilsætning. Hvad er pH i den? Er den neutral?
Men man kan løse den således: (jeg bruger din Ka værdi)
I opløsningen før tilsætning gælder, at
![K_a=\frac{0,04\cdot [H_3O^+]}{0,154}](https://media.studieportalen.dk/images/equations/bx-iK6I9V_UL09mRZfljfQ==.gif)
Efter tilsætningen, og når systemet igen er i ligevægt, gælder der, at
![K_a=\frac{(0,045 -x)\cdot [H_3O^+]}{(0,154+x)}](https://media.studieportalen.dk/images/equations/TzpgL837vDk6rJGC4z57Nw==.gif)
hvor x er en ændring i koncentrationerne.
Da styrkekonstanten er, .. ja, konstant, kan vi sætte de to udtryk lig hinanden, og opdage at [H3O+] går ud:
![\frac{0,04\cdot [H_3O^+]}{0,154}=\frac{(0,045 -x)\cdot [H_3O^+]}{(0,154+x)}](https://media.studieportalen.dk/images/equations/QocmyGMMOV5e0nAjtS6-Yw==.gif)
Heraf kan ligevægtskoncentrationerne beregnes, og [H3O+] kan bestemmes:
![\newline K_a=\frac{(0,045 -0,004)\cdot [H_3O^+]}{(0,154+0,004)} \newline \newline [H_3O^+]=0,040771707](https://media.studieportalen.dk/images/equations/MKmoxRcFj1RWkNt5x6l-XQ==.gif)
Så pH i den nye opløsning er:
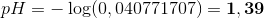
(har været lidt doven med enheder)
Måske var det det du kom til at beregne i b? :P
Svar #5
02. november 2014 af arissen (Slettet)
#1 Det er den originale opgavetekst for den opgave :/
I b) har jeg brugt den k_s værdi jeg beregnede i a) og ikke den fra databogen. Får også 1,51 hvis jeg benytter pK_s fra databogen... Skal jeg bruge den fra databogen?? :) Synes bare det gav mening at benytte den jeg lige havde beregnet... hahah
#4 vi får ingen pH eller andet oplyst for opløsningen :(
Svar #6
02. november 2014 af arissen (Slettet)
Skal vi slet ikke benytte at vi får oplyst volumen af opløsningen?
Svar #7
02. november 2014 af arissen (Slettet)
Eller er vi ligeglade med det fordi volumen ikke ændres?
Svar #8
02. november 2014 af OliverGlue
#4
Forstår ikke hvordan hydronium kan forkortes væk, det er to uafhængige systemer, så de er ikke lig hinanden.
#6
Tit får man oplyst en masse værdier, hvoraf du kun skal benytte få af dem. #7 er argument for at vi blot kan arbejde i koncentrationer. I øvrigt læser jeg det blot som to koncentrationer vi arbejder med, når chlorit øges til 0.45M sker der ingenting med koncentrationen af chlorsyrling, i mit hoved.
For at gøre det lidt mere intuitivt kan vi også betragte det inden tilsætning af chlorit:
solve(1.058*10^(-2) = (0.4e-1+x)*x/(.154-x), x) = 0.0223 => -log10(0.0223)=1.65
Det vil sige pH stiger en smule efter tilsætning, altså hydronium koncentrationen falder, hvilket giver god mening hvis det betragtes med Le Châteliers princip.
Svar #9
02. november 2014 af Heptan
#5
Brug styrkekonstanten fra a)'eren, og undgå fejl, det burde give det samme.
#8 Du har ret, de er self. ikke ens
I din udregning, hvad er da x? Der er jo tale om en ligevægt, så pH i opløsningen med 0,154 M chlorsyrling og 0,040 M chlorit må jo simpelthen være: (det var faktisk en god idé at udregne den, for så kender vi [H3O+]før i den ligning jeg opstillede)
![\newline [H_3O^+]_{f\o r}=1,058\cdot 10^-^2 \cdot \frac{0,154}{0,040}=0,040733\ M \newline \newline pH=1,39](https://media.studieportalen.dk/images/equations/PRaFjb2YJKZDYYmrCmaL-w==.gif)
Nu kender vi altså [H3O+]før.
Der tilsættes chlorit, så initialkoncentrationen bliver 0,045. Reaktionen forløber mod venstre, så der forbruges chlorit og oxonium. Hvis vi betegner ændringen x, vil der gælde følgende om ligevægt 2:
![1,058\cdot 10^-^2=\frac{0,045-x}{0,154+x} \cdsot (10^{-1,39}-x) \newline \newline \Leftrightarrow x=0,0023506977 \newline \newline [H_3O^+]_{ligev \ae gt\ 2}= (10^{-1,39}-x)=0,03838733\ M \newline \newline pH=1,41](https://media.studieportalen.dk/images/equations/Uk7m3AQl_rIhQafC7Wj36Q==.gif)
pH ændres altså med +0,02 pH-enheder, hvilket er intuitivt, da ligevægten må forskydes mod venstre.
Svar #11
02. november 2014 af OliverGlue
#9 Du har ret, der er selvfølgelig hydronium i opløsning fra start.
Jeg får dog en lidt anden ændring i koncentrationerne ift. dig
Start hydronium-koncentrationen er den samme
![K_{\mathrm{a}}=\mbox{\ensuremath{\mathrm{\dfrac{[ClO_{2}^{-}][H_{3}O^{+}]}{[HClO_{2}]}}}}\Leftrightarrow\mathrm{[H_{3}O^{+}]}=\mbox{\ensuremath{\mathrm{\dfrac{0.154\cdot1.058\times10^{-2}}{0.040}=0.040733\, M}}}](https://media.studieportalen.dk/images/equations/ljRQW8NeKdD6mArwAqpQ0g==.gif)
Men ved tilsætning af chlorit
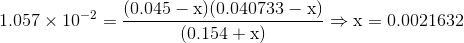
Som alligevel giver samme pH på første 3 betydende cifre
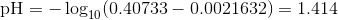
Skriv et svar til: Beregn pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.