Kemi
Hvorfor er 1g natriumiodid nok til at sikre, at hydrogenperoxid reagerer?
Hejsa folkens,
sidder lige med min kemi rapport om H2O2-indholdet i et desinfektionsmiddel og der er et "extra spørgsmål til de ihærdige". Jeg vil gerne prøve den, men har ingen anelser om, hvad jeg skal gøre. Er der nogen der måske lige kan hjælpe lidt?
Opgaven lyder: Vis at 1g natriumiodid burde være mere end nok til at sike at al hydrogenperoxiden reagerer.
Svar #2
09. februar 2015 af Soeffi
#0Hejsa folkens,
sidder lige med min kemi rapport om H2O2-indholdet i et desinfektionsmiddel og der er et "extra spørgsmål til de ihærdige". Jeg vil gerne prøve den, men har ingen anelser om, hvad jeg skal gøre. Er der nogen der måske lige kan hjælpe lidt?
Opgaven lyder: Vis at 1g natriumiodid burde være mere end nok til at sike at al hydrogenperoxiden reagerer.
Hvilken reaktion? Hvis det er spaltning af H2O2, virker I- som katalysator.
Svar #3
09. februar 2015 af mathon
3 H2O2 + NaI ---> 3 H2O + NaIO3
ækvivalente mængder 102,042 g 149,89 g
0,6808 g 1,000 g
hvis m(H2O2) < 0,6808 g burde 1 g NaI være nok til at al hydrogenperoxiden reagerer.
Svar #4
09. februar 2015 af foly (Slettet)
De to reaktioner vi fik er:
a. H2O2 + I- -> H2O + I2 (ikke afstemt)
b. I2 + S2O32- -> I- + S4O62- (ikke afstemt)
Og stofmængden af H2O2 = n(H2O2) = 0,00184mol / 2 (fordi de reagerer i forhold 1:2) = 0,00092 mol
Svar #5
09. februar 2015 af mathon
OK
a. H2O2 + 2 I- + 2 H+ --> 2 H2O + I2
b. I2 + 2 S2O32- --> 2 I- + S4O62-
Svar #6
09. februar 2015 af mathon
a. H2O2 + 2 I- + 2 H+ --> 2 H2O + I2
ækvivalente mængder: 34,014 g 253,8 g
40,177 g 0,8466 g svarende til 1 g NaI hvoraf 84,66% er I.
hvis m(H2O2) < 40,177 g = 1,18 mol burde 1 g NaI være nok til at al hydrogenperoxiden reagerer.
…
Beregning af I-procent i NaI:
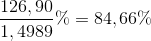 M(NaI) = 149,89 g/mol
M(NaI) = 149,89 g/mol
Skriv et svar til: Hvorfor er 1g natriumiodid nok til at sikre, at hydrogenperoxid reagerer?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.










