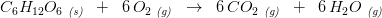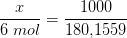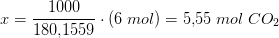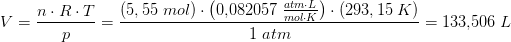Kemi
Eksamens spørgsmål i kemi
Vis hvordan man kan beregne CO2 belastning under forbrænding af et kg træ (C6H12O6)
HJÆLP!!!!!!
Svar #2
09. juni 2015 af Mikkelthomsen29 (Slettet)
Og hvordan man finde CO2 belastningen
Svar #3
09. juni 2015 af Soeffi
#0 Vis hvordan man kan beregne CO2 belastning under forbrænding af et kg træ (C6H12O6)
Det, der menes, er nok, hvor meget CO2, der dannes og dermed hvor stor en CO2-belastning, der sker af miljøet.
Træ har ikke formlen C6H12O6, det er derimod formlen for kulhydrat.
Svar #5
09. juni 2015 af Mikkelthomsen29 (Slettet)
C6H12O6 C6H12O6 + CO2 + H2O
m 1000g
MW 95,94 pr. mol
m 10,42mol
Ved ikke hvad jeg gør her fra??????????
Skriv et svar til: Eksamens spørgsmål i kemi
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.