Kemi
Kemisk ligevægt. Hjælp!
Hej, jeg sidder og kigger på en opgave ang. ligevægte.
Opgaven lyder således:
Ligevægtskonstant værdi : 1,6 ved 720 grader celsius.
H2(g) + CO2(g) ? H2O (g) + CO(g)
I en beholder findes ved stuetemperatur en blanding af de fire gasser med følgende patrial tryk:
p(H2) = 0,54 bar
p(CO2) = 1,07 bar
p( H2O)= 1,50 bar
p(CO) = 2,11
Jeg har svaret på første spørgsmål:
a) Beregn reaktionsbrøken ved stuetemeratur
Y = P(H2O)*P(CO) / P(H2O)* P(CO2)
Y= 1,50 bar * 2,11bar / 0,54 bar * 1,07 bar = 5,5
Har nu problemer med 2. spørgsmål:
b) I hvilken retning forløber nettoreaktionen ?
Jeg har et bud, men tror ikke det er rigtig. Mit bud er at den forløber mod venstre, da den beregnede ligevægtskonstant ved stuetemperatur er højere end den givne til 1,6 ved 720 grader celsius.
Håber I kan hjælp med spørgsmål b!
På forhånd tak
Svar #1
10. januar 2016 af mathon
Betænk
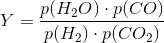 nu bliver større
nu bliver større
dvs
tælleren bliver større og nævneren bliver mindre.
I hvilken retning forskydes ligevægten
H2 (g) + CO2 (g) 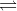 H2O (g) + CO (g)
H2O (g) + CO (g)
da?
Svar #2
10. januar 2016 af Katrine0127 (Slettet)
Bliver den så forskudt mod højre? Ved ikke om jeg har fanget det helt?
Svar #4
10. januar 2016 af Katrine0127 (Slettet)
Jeg kan ikke helt se hvorfor. Er det ikke noget med, at den skal forskydes mod venstre hvis tallet i tælleren er større? for så er Yc større end Kc ?
Svar #5
10. januar 2016 af Heptan
Du har beregnet reaktionsbrøken, ikke ligevægtskonstanten, som jo er ... konstant.
Reaktionen vil forløbe i en retning, indtil reaktionsbrøken er lig med ligevægtskonstanten. Da Y > K vil reaktionen forløbe mod venstre, da Y skal blive mindre for at blive lig med K.
Svar #6
11. januar 2016 af mathon
SORRY
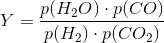
dvs
tælleren skal mindskes og nævneren øges.
I hvilken retning forskydes ligevægten
H2 (g) + CO2 (g) 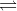 H2O (g) + CO (g)
H2O (g) + CO (g)
da?
Svar #8
11. januar 2016 af mathon
men denne temperaturafhængighed forkortes ud i netop denne reaktion.
Svar #9
11. januar 2016 af Heptan
Vil det sige at reaktionen er uafhængig af temperaturen? Kan du vise hvor det forkortes ud?
Svar #10
11. januar 2016 af Katrine0127 (Slettet)
Jeg tror, at jeg forstået princippet nu! I skal have mange tak for hjælpen.
Mener at reaktionen er afhængig af temperaturen, kan i hvertfald godt forstår nu hvorfor det er den forskydes mod venstre
Skriv et svar til: Kemisk ligevægt. Hjælp!
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.








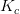 og
og 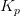 er temperaturafhængige.
er temperaturafhængige.