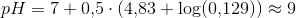Kemi
kemi hjælp!
Nogen der kan hjælpe med det vedhæftede? :) Tak på forhånd
Svar #1
29. januar 2016 af Annamisa
a) Beregn den formelle stofmængdekoncentration af butansyre i opløsningen.
Du skal bruge formlen n/v = c, (stofmængde/volumen = koncentrationen) for at finde koncetrationen, men for at kunne gøre dette må du først kende stofmængden.
Den finder du ved formlen m/M = n (massen/molarmassen = stofmængden). Du kender allerede massen, og molarmassen kan du finde ved at se i dit periodiske system.
b) Beregn pH i den vandige opløsning af butansyre ved 25
Burde kunne lade sig gøre ved...
c(C4H8O2)= c(H30+)
pH = -log(c(H30+))
Svar #7
24. januar 2017 af wergfdwergfdvergfv (Slettet)
mathon, jeg fatter intet om det der pH formlen.
Kan du forklar hvad du gøre??
Svar #8
13. august 2022 af Aktiemester (Slettet)
#4c)
titerligning:
En indikator med omslagsområde
Hej Mathon
Jeg har et spørgsmål ang. svar 4, 5, 6. Har du nogle formler til dine beregninger (som du kan vise), dine resultater er self rigtige, men kan ikke rigtig forstå din fremgangsmåde
Svar #11
14. august 2022 af Aktiemester (Slettet)
#10#9
Ah okay, kan se din pointe. Har du formler til spg c) og d)?
Svar #13
14. august 2022 af Aktiemester (Slettet)
Hvilke formler det er, som du bruger i opgave c) og opgave d) som du derefter omskriver.
Svar #16
14. august 2022 af Aktiemester (Slettet)
Mange tak for svar (gør det lidt nemmere at forstå, når man ikke kan huske alle formlerne og reglerne i kemi)
Svar #17
21. august 2022 af Aktiemester (Slettet)
#14
#15
Kan du igen vise hvilke formler det er, som du bruger i opgave c) og opgave d) som du omskriver? Kan nemlig ikke se dem (ved ikke lige hvorfor)
Svar #18
21. august 2022 af Aktiemester (Slettet)
#13Hvilke formler det er, som du bruger i opgave c) og opgave d) som du derefter omskriver.
kan du hjælpe med dette?
Svar #19
21. august 2022 af Aktiemester (Slettet)
Håber virkelig du kan hjælpe #Mathon, (skal afleveres i morgen)
Svar #20
21. august 2022 af OliverHviid
Til c'eren bruges der n=cv og d'erens formel har mathon allerede skrevet op.
Den er: pOH=(1/2)*(pKb-log(cb))
Skriv et svar til: kemi hjælp!
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






![\frac{\left [ H_3O^+ \right ]^2}{c_s-\left [ H_3O^+ \right ]}=10^{-4{,}83}\; \; \; \; 0<\left [ H_3O^+ \right ]<c_s](https://media.studieportalen.dk/images/equations/u0fD1lYZuj4Z_ipa9kKjPw==.gif)
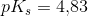
![pH=-\log\left ( \left [ H_3O^+ \right ]/M \right )](https://media.studieportalen.dk/images/equations/gUMKfq3NE3pfqnsRXRtrjA==.gif)
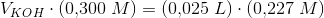
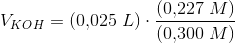
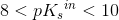
![\left [ C_3H_7COO^- \right ]=\left ( \frac{25}{43{,}92} \right )\cdot \left ( 0{,}227\; M \right )=0{,}129\; M](https://media.studieportalen.dk/images/equations/5IWPQn6L4t-OYxatVfoV-g==.gif)
![pH=7+0{,}5\cdot \left ( pK_s+\log([B]) \right )](https://media.studieportalen.dk/images/equations/wqs-C_FrE53MN8e8RPRycQ==.gif)