Kemi
Opløselighedsproduktet - uorganisk kemi
Opløselighedsproduktet for MgF2 er 8*10-8 M3.
a) Hvor mange mg MgF2 kan man opløse i 250 ml vand?
b) Antag at man i stedet opløser magnesiumfluoridet i en opløsning som i forevejen indeholder magnesiumnnitrat. Mindsker eller øger den molære opløselighed? Svaret skal begrundes.
c) Beregn den molære opløselighed af MgF2 i 0.200 M Mg(NO3)2.
Nogle der vil hjælpe med denne opgave?
Svar #2
29. maj 2016 af mathon
b)
Opløseligheden af 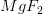 i en opløsning, der i forvejen indeholder
i en opløsning, der i forvejen indeholder 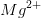 er mindre end i rent vand,
er mindre end i rent vand,
da opløselighedsproduktet ikke må overskrides.
Den opløste mængde af 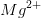 er negligeabel i forhold til de i forvejen forekommende
er negligeabel i forhold til de i forvejen forekommende 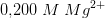
hvoraf
c)
for opløseligheden af 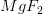
![\! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \! \left [Mg^{2+} \right ]_{opl}=\frac{1}{2}\cdot \left [F^{-} \right ]_{opl}=\frac{1}{2}\cdot \sqrt{\frac{8\cdot 10^{-8\; M^3}}{\left [ Mg^{2+} \right ]_{eks}}}=\frac{1}{2}\cdot \sqrt{\frac{8\cdot 10^{-8}\; M^3}{\left [ 0{,}200\; M \right ]}}=3{,}1623\cdot 10^{-4}\; M](https://media.studieportalen.dk/images/equations/BEY5LeJ4_9dRUglauVNbMQ==.gif)
Den molære opløselighed af 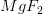 i
i 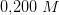
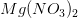 er
er 
Skriv et svar til: Opløselighedsproduktet - uorganisk kemi
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






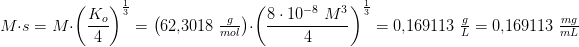
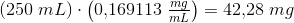

![\left [Mg^{2+} \right ]\cdot \left [F^{\, -} \right ]^2=K_o](https://media.studieportalen.dk/images/equations/RouLrXOG_jLi4NI4QSLopg==.gif)
![\left [ Mg^{2+} \right ]=\left [ MgF_2 \right ]=s](https://media.studieportalen.dk/images/equations/ArJb1-QihMO2Skw4fd_rpg==.gif)
![\left [ F^{\, -} \right ]=2\cdot \left [ MgF_2 \right ]=2s](https://media.studieportalen.dk/images/equations/Vwtos8oTbPbYQlCZBSCYrg==.gif)
![\left [Mg^{2+} \right ]\cdot \left [F^{\, -} \right ]^2=s\cdot (2s)^2=K_o](https://media.studieportalen.dk/images/equations/c8OONi_m6UhqbYHXg-KiKA==.gif)
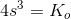
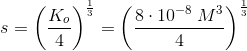
![a^{\frac{1}{3}}=\sqrt[3]{a}](https://media.studieportalen.dk/images/equations/X_XG60ZQygZYyigFRuS2mg==.gif)