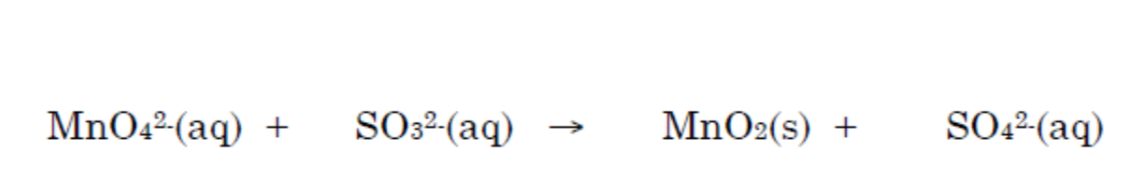Kemi
kemi
Hvordan beregner jeg hvor mange sulfitioner der skal til for at reducere en permangantion til en Mg2+
skal jeg bruge formler til noget? hvordan finnder jeg ud af det ved brug af de afstemte reaktionnskemaer
Svar #2
21. marts 2018 af Sarah3310 (Slettet)
Her er den -->
Svar #4
21. marts 2018 af Sarah3310 (Slettet)
Hvordan beregner jeg hvor mange sulfitioner der skal til for at reducere en permangantion til en Mg2+
Svar #6
21. marts 2018 af Sarah3310 (Slettet)
Vis ved beregning, at der er rigelig sulfitioner til at gennemføre reduktionen
Hvordan beregner jeg dette?
Skriv et svar til: kemi
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.