Kemi
cis og trans kogepunkter
Hej.
Nogen der kan hjælpe mig med denne opgave?
Tak på forhånd :-)
Svar #2
26. april 2020 af janhaa
Boiling point of cis isomers are higher than trans isomers because cis isomers are polar and hence they have strong intermolecular forces between the molecules. Because of this high polarity and high intermolecular force, a lot of energy will be required to break the bonds. Hence, cis isomers have higher boiling point.
Svar #3
26. april 2020 af Soeffi
#1. For en ordens skyld...der gælder:
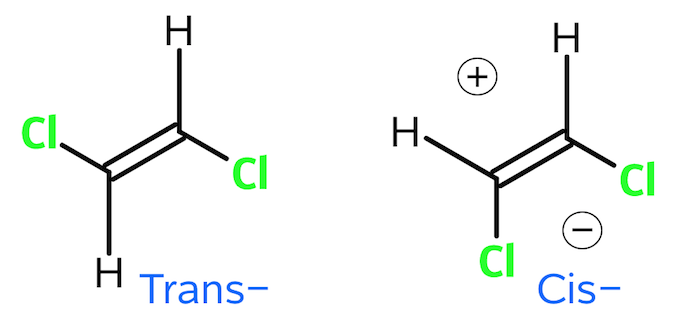
Cis-1,2-dichlorethen Trans-1,2-dichlorethen
Smeltepunkt: -81 °C -49 °C
Kogepunkt: 60 °C 49 °C
Det ses, at trans-1,2-dichlorethen har det højeste smeltepunkt, mens cis-1,2-dichlorethen har det højeste kogepunkt.
Højt smeltepunkt hænger først og fremmest sammen med molekylernes evne til at pakke sig sammen. Her er trans-forbindelsen bedst, fordi atomerne er mere jævnt fordelt end i cis-forbindelsen.
Højt kogepunkt derimod hænger først og fremmest sammen med højt dipolmoment, og her er cis-forbindelsen bedst, fordi de to meget elektronegative Cl-atomer og de to mindre elektronegative H-atomer er samlet på hver sin side af dobbeltbindingen. (Se nedenfor.)
Skriv et svar til: cis og trans kogepunkter
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



