Kemi
Bindinger og kogepunkt
Er der nogen der kan hjælpe med denne her: (bilag)
Svar #1
02. april 2021 af AngelOneOne
Hej,
I 1, er det polariteten af molekylet der afgør kogepunktet. Elektronegativitetsforskellem mellem H og F og H og Cl, afgør, hvor tæt elektronparret trækkes på hhv. F og Cl. Jo højere forskel, desto tættere trækkes elektronparret, og desto mere polært bliver molekylet. Dermed bliver dispersionskræfterne også højere, og ved højere dispersionskræfter, desto højere kogepunkt.
I 2 er det forskellen mellem molvægten der afgør hvilket stof der har højest kogepunkt.
Ved organiske molekyler, er der normalt to faktorer der spiller ind - størrelse (molvægt) og dispersionskræfter. Jo større et upolært molekyle er, desto højere kogepunkt har det i forhold til et lignende upolært stof. En alkan med 4 C-atomer har et lavere kogepunkt end en alkan med 7 C-atomer, da den sidste er tungere end den første.
Ved polære organiske forbindelser, spiller dispersionskræfterne også ind, udover størrelsen. På grund af dipol-momentet mellem polære organiske forbindelser, 'hænger' de bedre fast i hinanden og kræver mere energi for at skifte tilstandaform. Det vil sige, at en alkohol med 5 C-atomer, godt kan have et højere kogepunkt, end en alkan med 6 C-atomer, på grund af dispersionskræfterne mellem dipolerne i alkoholen og på trods af, at alkoholen har en lavere molvægt.
Men den viden, burde du kunne løse opgaverne.
/Angel
/Angel
"The Universe is under no obligation to make sense to you" - Niel deGrasse Tyson
“Look deep into nature, and then you will understand everything better” - Albert Einstein
Svar #2
02. april 2021 af AngelOneOne
Hej,
I tillæg til #1 omkring nr. 2, kan det tilføjes, at jo højere molvægt et stof har, desto flere elektroner er der også til stede, og dermed er dispersionskræften også større, hvilket giver et højere kogepunkt.
Generelt kan man sige, at ovenstående beskriver hvad der har indflydelse på kogepunktet for et stof. Bindingernes styrke (polaritet), elektronegativitetsforskel, molvægt, dipolmoment, og dispersionskræfter. Med lidt øvelse, bliver det nemmere for dig, at finde ud af hvilke faktorer der er fremtrædende i forhold til kogepunktet.
/Angel
/Angel
"The Universe is under no obligation to make sense to you" - Niel deGrasse Tyson
“Look deep into nature, and then you will understand everything better” - Albert Einstein
Svar #3
02. april 2021 af AngelOneOne
/Angel
/Angel
"The Universe is under no obligation to make sense to you" - Niel deGrasse Tyson
“Look deep into nature, and then you will understand everything better” - Albert Einstein
Svar #4
02. april 2021 af AngelOneOne
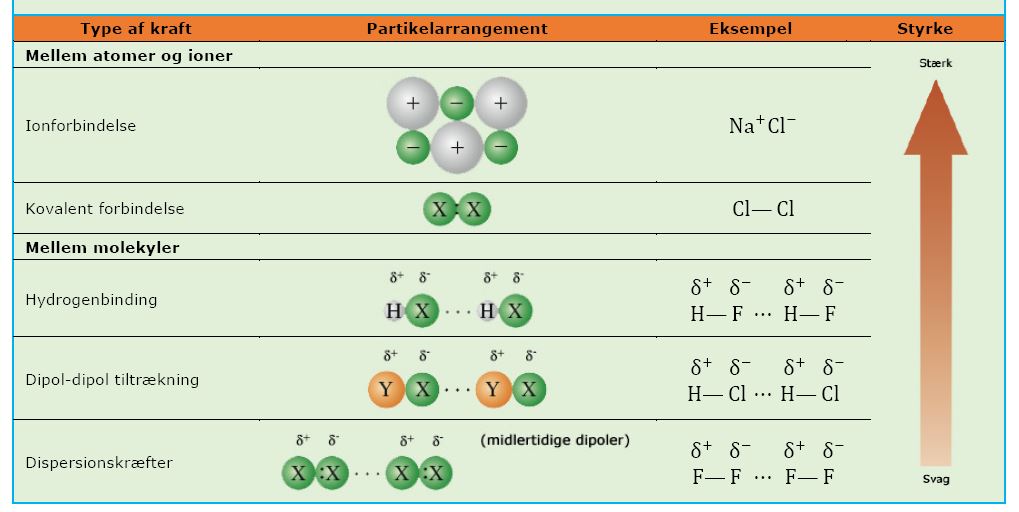
/Angel
"The Universe is under no obligation to make sense to you" - Niel deGrasse Tyson
“Look deep into nature, and then you will understand everything better” - Albert Einstein
Svar #5
02. april 2021 af AngelOneOne
Hej,
Retter lige mig selv - I 1, er det selvfølgelig forskellen i styrken mellem hydrogenbindingen og dipol-dipol tiltrækningen, der giver forskellen i kogepunktet.
i forhold til nr. 2 - Ved upolære forbindelser, afgør molvægten kogepunktet, da tungere molekyler, har flere elektroner, og dermed stærkere dispersionskræfter.
/Angel
/Angel
"The Universe is under no obligation to make sense to you" - Niel deGrasse Tyson
“Look deep into nature, and then you will understand everything better” - Albert Einstein
Svar #6
02. april 2021 af Hans12333
Hej, tror ikke det handler om molekylvægt her men kun om intermolekylære bindinger. Tror ikke det skal være så indviklet
Svar #7
02. april 2021 af AngelOneOne
Hej,
Molekylevægten er afgørende ved især upolære stoffer, da molekylevægten indirekte fortæller hvilke stoffer der indeholder flest elektroner, og dermed har de stærkeste midlertide dipoler (dispersionskræfter). Dette forudsætter naturligvis, at de omtalte stoffer ikke indgår andre intermolekylære forbindelser, som hydrogenbindinger, eller 'ægte' dipol-dipol bindinger, der er stærkere end de midlertidige dipoler.
Alkoholer indgår f.eks. hydrogenbindinger, og har derfor højere kogepunkter end dens tilsvarende alkan, og ofte også alkanen med et eller flere ekstra C-atom(er), fordi dispersionskræfterne mellem alkanens molekyler, er svagere end hydrogenbindingen mellem alkoholmolekylerne. Ved polære kovalente molekyler, der bestemmer elektronegativiteten, hvor tæt elektronparret (parrene) trækkes på det ene af atomerne, og dermed hvor meget forskel der er på dipolen i hver ende af molekylet. Ved upolære kovalente forbindelser, er det molvægten, og dermed antallet af elektroner, der bestemmer hvor stærke de midlertidige dipoler er, og dermen hvor højt kogepunktet er.
/Angel
/Angel
"The Universe is under no obligation to make sense to you" - Niel deGrasse Tyson
“Look deep into nature, and then you will understand everything better” - Albert Einstein
Svar #8
03. april 2021 af Hans12333
Hej igen. Ved 1, hvorfor bliver londonbindingerne (dispersionskrafterne) så kraftigere ved højere polaritet?
Svar #9
03. april 2021 af AngelOneOne
Hej,
Fordi elektronegativitetsforskellen er større i det ene molekyle end i det andet. Dermed bliver den ene ende af det molekyle hvor der er størst elektronegativitetsforskel mere negativt ladet end i det andet molekyle, og dermed er de intermolekylære kræfter stærkere.
/Angel
/Angel
"The Universe is under no obligation to make sense to you" - Niel deGrasse Tyson
“Look deep into nature, and then you will understand everything better” - Albert Einstein
Svar #10
03. april 2021 af Hans12333
Har læst at HF danner hydrogenbindinger, hvorimod HCl kun påvirkes af londonbindinger. Men hvorfor er det sådan, altså hvor går i grænsen i elektronegativitet, før at et molekyle kan danne hydrogenbindinger?
Svar #11
03. april 2021 af AngelOneOne
Hej,
Såvidt som jeg husker, så dannes der hydrogenbindinger mellem to molekyler, som begge indeholder de meget elektronegative atomer N, O, eller F. De dannes mellem A-H ··· B-H, hvor A og B enten er nitrogen, oxygen eller flour. HF's hydrogenbinding er så stærk, at den ikke kan skeles fra en kovalent binding. Denne utroligt stærke hydrogenbinding mellem HF molekyler, er også årsagen til dets meget højere kogepunkt end HCl. Den intermolekylære binding i HCl er en dipol-dipol, da Cl atomet trækker mere i elektronparret end H atomet gør, og derved får HCl en positivt ladet og negativt ladet ende, og da HF molekylets hydrogenbinding er så ekseptionelt stærk (en af de stærkeste hydrogenbinginger der findes), gør det at HF's kogepunkt er meget højere end HCl's.
Londonbindinger dannes når hverken hydrogenbindinger, ion-dipol-bindinger, eller dipol-dipol-bindinger dannes. Det er f.eks. mellem kulbrinter der kun indeholder C og H. Hvis kulbrinterne indeholder blot en OH-gruppe, vil de danne hydrogenbindinger til andre OH-grupper i kulbrinten. Londonbindinger opstår når elektronerne er ujævnt fordelt, f.eks. bliver et H2 molekyle kortvarigt polært, når elektronskyen bliver forskudt over til det ene H-atom. Dermed induceres der en svag tiltrækningskraft, da elektronerne frastøder og tiltrækker nabomolekylerne på grund af sine kortvarige elektrisk ladede poler. Jo relativt længere molekyleformen er, frem for kompakt, desto stærkere er londonbindingerne de indgår.
/Angel
/Angel
"The Universe is under no obligation to make sense to you" - Niel deGrasse Tyson
“Look deep into nature, and then you will understand everything better” - Albert Einstein
Svar #12
03. april 2021 af Hans12333
Okay så altså generelt kan molekyler kun danne 1 ting, som hydrogenbindinger eller dipol-dipolbindinger, men aldrig feks hydrogenbindinger og londonbindinger samtidigt?
Svar #13
03. april 2021 af AngelOneOne
Hej,
De intermolekylære kræfter er bestemt af hvilke stoffer det er. Hvis det er polære stoffer, er det ion-ion-bindinger, hvis stoffet er sammensat af et metal, og et ikkemetal, og dipol-dipol, hvis molekylet har en udpræget positiv og en udpræget negativ ende. ion-dipol bindinger er når det f.eks. er et salt der opløses i et opløsningsmiddel (f.eks. NaCl i vand). Hydrogenbindinger opstår mellem molekyler der indeholder stærkt elektronegative atomer (N, O, eller F) og hydrogen. Dispersionskræfter (londonbindinger) opstår, når ingen andre intermolekylære kræfter er tilstede på grund ujævn elektronfordeling, som kortvarigt gør molekylet polært. Jo længere molekyleformen er, desto stærkere dispersionskræfter.
Bindingens art Typiske bindingsenergier
ion-ion 300 kJ/mol
ion-dipol 15 kJ/mol
dipol-dipol, fast fase 2 kJ/mol
dipol-dipol, gas og væske 0,2 kJ/mol
dispersionskræfter 2 kJ/mol
hydrogenbinging 20 kJ/mol
/Angel
/Angel
"The Universe is under no obligation to make sense to you" - Niel deGrasse Tyson
“Look deep into nature, and then you will understand everything better” - Albert Einstein
Skriv et svar til: Bindinger og kogepunkt
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



