Kemi
Kemisk Reaktionshastighed
Opgavebeskrivelsen er vedhæftet, og selve spørgsmålene lyder:
a) Afbild absorbansen som funktion af tiden.
b) Vis at reaktionen er af første orden mht. phenolphtalein. Hint: 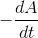 skal kendes for to punkter`?
skal kendes for to punkter`?
Jeg har lavet opgave a og tegnet grafen, men forstår ikke hvordan jeg skal vise at reaktionen er af første orden. Tak på forhånd ;-)
Svar #2
21. februar 2015 af Heptan
Bestem hældningen for grafen i to punkter, beregn reaktionshastigheden for de to punkter og sammenlign reaktionshastighederne. Du kan evt. vælge start og ½A som punkter, og bruge de tre formler for halveringstiden for hhv. nulte, første og anden orden.
Svar #5
21. februar 2015 af Ib2012 (Slettet)
Hvad er E og l i ligningen og kender vi disse værdier????
Svar #6
21. februar 2015 af Heptan
Det er det græske bogstav varepsilon, ε, og kuvettebredden l (lille L).
Værdierne er konstante, så du kan se bort fra dem.
Svar #7
21. februar 2015 af Ib2012 (Slettet)
Har lavet følgende udregninger og grafer på Ti-Nspire, men ved ikke hvordan jeg ud fra det skal bevise at det er første orden???
Svar #9
21. februar 2015 af Ib2012 (Slettet)
Jeg er utrolig taknemmelig for jeres hjælp og jeres formler forstår jeg næsten også 100%, tror bare der hvor snoren knækker er at jeg stadigvæk har lidt svært ved at forstå den formel der er givet i opgaven, altså har svært ved at se sammenhængen mellem absorbansen og koncentrationen af phenolpthalein, vi har nemlig kun lavet opgaver af disse, hvor vi tog udgangspunkter i koncentrationer????
Skriv et svar til: Kemisk Reaktionshastighed
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






![v=-\frac{\mathrm{d} \left [ Ph \right ]}{\mathrm{d} t}=-\frac{1}{\varepsilon \cdot l}\cdot \frac{\mathrm{d} A}{\mathrm{d} t}](https://media.studieportalen.dk/images/equations/_Wno-vKSo3yHXB2szCpACg==.gif)
![v=-\frac{\mathrm{d} \left [ Ph \right ]}{\mathrm{d} t}=k\cdot \left [ Ph \right ]^0](https://media.studieportalen.dk/images/equations/LhSR_g52gjxVHc3QSo-nFQ==.gif)
![\left [ Ph \right ]_t=-k\cdot t+\left [ Ph \right ]_0](https://media.studieportalen.dk/images/equations/U2j13h55YTzPkxk9ZLz7-A==.gif)
![T_{\frac{1}{2}}=\frac{3}{2}\cdot \frac{\left [ Ph \right ]_0}{k}](https://media.studieportalen.dk/images/equations/qmWphZdYVmc0JlceL_3IAQ==.gif)
![v=-\frac{\mathrm{d} \left [ Ph \right ]}{\mathrm{d} t}=k\cdot \left [ Ph \right ]^1](https://media.studieportalen.dk/images/equations/FNfAKWEOcAPysPoTK3VQ1A==.gif)
![\left [ Ph \right ]_t=\left [ Ph \right ]_0\cdot e^{-kt}](https://media.studieportalen.dk/images/equations/8bbHoxW60T8WsuLdvDJDNg==.gif)
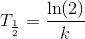
![v=-\frac{\mathrm{d} \left [ Ph \right ]}{\mathrm{d} t}=k\cdot \left [ Ph \right ]^2](https://media.studieportalen.dk/images/equations/SwHu5VT5cMsI19Nt-AZoKA==.gif)
![\left [ Ph \right ]_t=\frac{\left [ Ph \right ]_0}{1+\left [ Ph \right ]_0\cdot k\cdot t}](https://media.studieportalen.dk/images/equations/AQkPRbRds06Mailc6qfTeA==.gif)
![T_{\frac{1}{2}}= \frac{1}{k\cdot \left [ Ph \right ]_0}](https://media.studieportalen.dk/images/equations/QfQXhyGUwUyr7yv2sLVZ6Q==.gif)
![\frac{1}{2}\cdot \left [ Ph \right ]_0=-k\cdot t_{1/2}+\left [ Ph \right ]_0 \\ \\ \Leftrightarrow t_{1/2}=\frac{[Ph]_0}{2\cdot k}](https://media.studieportalen.dk/images/equations/1jtEnQR02tDha1ueMQM42A==.gif)
![T_{\frac{1}{2}}=\frac{\left [ Ph \right ]_0}{2k}](https://media.studieportalen.dk/images/equations/hm6EQmjmq9Xz2b7l2fMcuQ==.gif)
![\left [ Ph \right ]=C\cdot A\; \; \; \; \; \; \left [ Ph \right ]\; og\; A\; er\; proportionale](https://media.studieportalen.dk/images/equations/piGsL_MlI8ke4HhkdnSrSw==.gif) hvor
hvor 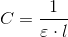
![\left [ Ph \right ]](https://media.studieportalen.dk/images/equations/062gTrBPlBelO8pR5raWHQ==.gif) og
og 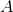 har samme form.
har samme form.![v=k\cdot \left [ Ph \right ]=k\cdot \frac{1}{\varepsilon \cdot l}\cdot A](https://media.studieportalen.dk/images/equations/_7PWAGWwaSyGByguqSu5kA==.gif)
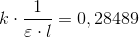
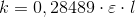
=[A]_0\cdot e^{-kt}](https://media.studieportalen.dk/images/equations/_LcMSXa6Al5OFKuM60jhWg==.gif)