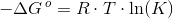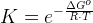Kemi
Termodynamik - Hvornår skal man bruge formlerne?
Hej.
Jeg er meget i tvivl om, hvordan jeg skal bruge, hvilke formler i termodynamik.
Hvis jeg sidder med en opgave, hvor jeg skal finde ligevægtskonstanten (til 60 C), kan jeg ikke finde frem til om, jeg skal bruge
-?G° = R * T * lnK
eller om jeg skal bruge
Van't Hoffs ligning.
Og hvad vil det sige, at ?H, ?S° og ?G° er enten uafhængige er temperaturen eller afhængige af temperaturen?
Mange tak på forhånd!
Svar #2
18. marts 2015 af Studieportalpigen (Slettet)
Okay tak! Men hvornår skal man så bruge Van't Hoffs ligning?
Svar #4
18. marts 2015 af Studieportalpigen (Slettet)
Okay, men i dette tilfælde kender jeg deltaG°, delta S° og delaH°. Jeg har beregnes mig frem til deltaG° i en anden opgave.
Kan jeg så bruge begge formler?
Svar #5
18. marts 2015 af Heptan
Husk at 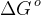 er temperaturafhængig, så det kræver at temperaturen er den samme. Det er måske bedst at bruge de andre, hvis temperaturen varierer, dvs. van't hoffs ligning.
er temperaturafhængig, så det kræver at temperaturen er den samme. Det er måske bedst at bruge de andre, hvis temperaturen varierer, dvs. van't hoffs ligning.
Svar #6
18. marts 2015 af Studieportalpigen (Slettet)
Okay, så når man har en opgave, hvor temperaturen fx. af 50°C gennem hele opgaven, skal jeg bruge deltaG°, fordi den er temperaturafhængig?Hvad hvis jeg nu ikke har fået opgivet delta deltaG°? Skal jeg så først finde den ved hjælp af deltaS° og deltaH°?
Hvad med deltaS° og deltaH°? Er de ikke temperaturafhængige?
Svar #7
18. marts 2015 af Heptan
Hvis du ikke har fået opgivet delta G° og du skal beregne ligevægtskonstanten K, så kan du bruge van't hoffs ligning. Hvis du allerede kender ligevægtskonstanten, kan du beregne delta G° ved hjælp af ligevægtskonstanten.
Man kan med god rimelighed antage, at deltaS° og deltaH° er uafhængige af temperaturen.
Svar #8
19. marts 2015 af Studieportalpigen (Slettet)
Hvis de er uafhængige af temperautren, vil det så sige, at temperautren kan ændre sig?
Svar #9
19. marts 2015 af Heptan
Ja, uden at de også ændrer sig.
Fx, hvis jeg koger 10 kartofler i 1 L vand, så har jeg stadig 10 kartofler når de er kogt, men jeg har ikke 1 L vand, der er forsvundet noget ... Antallet af kartofler er uafhængig af temperaturen, men det er vandet ikke.
Svar #10
19. marts 2015 af Studieportalpigen (Slettet)
Nu forstår jeg! Tusind tak for din forklaring :) Det hjalp mig i hvert fald!
Skriv et svar til: Termodynamik - Hvornår skal man bruge formlerne?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.