Fysik
Tilført varme samt entropi - Isobare proces
T1 = 90 K
T2 = 110 K - opvarmet under en isobar proces
V1=1,00m^3 atmosfærisk luft
V2 =1.44m^3
tryk = 1.7*10^-4 Pa
Er der nogen der kan hjælpe mig med at udregne hvor meget varme der bliver tilført gassen under den isobare proces, samt hvor meget entropien stiger under processen?
mht. til varmen havde jeg tænkt at noget med Q=ΔU-W
W kan jeg vel forholdsvis nemt regne udfra -p(V2-V1)
Men jeg ved ikke hvordan jeg skal komme frem til hvad ΔU er? Jeg er egentlig også usikker på, hvorvidt det er den rigtige måde at regne det på?
Mht. entropien, så ved jeg virkelig ikke hvordan den skal regnes..
Så håber virkelig på, at der er nogen som kan hjælpe :-)
På forhånd tusind tak!
Svar #1
28. marts 2016 af Heptan
Noget af varmen går til at udvide gassen, og noget går til at opvarme gassen. Du har beregnet hvor meget varme der skal til at for at udvide gassen, men du har problemer med at beregne hvor meget der skal til for at opvarme. Der er du nødt til at vide hvilken type gas der er tale om, fordi nogle gasser kræver mere varme end andre.
For en isobar proces er varmen tilført givet ved
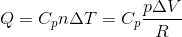
hvor Cp er den molære varmekapacitet ved konstant tryk.
Svar #3
28. marts 2016 af Student015 (Slettet)
Først beregner jeg Cp med formlen Cv+R, også indsætter jeg ellers bare værdierne i formlen for Q, men jeg får Q til at være 0.00029. Er det ikke et meget lille tal?
Mht. formel nr 2.
Hvad skal jeg angive n til at være? :/
Svar #4
28. marts 2016 af Heptan
Du har ikke oplyst hvilken værdi Cv har.
Det er et lille tal, fordi trykket er ekstremt lille - en milliard gange mindre end atmosfærestryk. Tjek dine enheder.
Svar #5
28. marts 2016 af Heptan
n er gassens stofmængde. Du kan beregne den med idealgasligningen ved en vilkårlig tilstand.
Svar #6
28. marts 2016 af Student015 (Slettet)
Jeg har i en tidligere opgave, udregnet Cv til at være 24.94 for svovldioxid (ved ikke hvilken enhed det skal have?)
Okay, så mit 2.9*10^-4 er ikke total ved siden af?
Stofmængden får jeg til at være 2.68*10^-7
og får den samlede ændring i entropien til 1.55*10^-11.
Både n og ΔS virker til at være nogle MEGET små til ifl. mine udregninger? :s Igen.. hvilke enheder skal mine resultater have? :/
Svar #7
28. marts 2016 af Heptan
Prøv at tjekke om der virkelig står 1,7 · 10-4 Pa i opgavebeskrivelsen. Istedet for at regne med tal, så regn med enheder, så kan det ikke gå galt. Enheder kombinerer typisk eller går ud med hinanden, og så får du automatisk enheder på resultatet.
Den Cv du har regnet i tidligere opgave har nok enheden J/(mol K)
Svar #8
28. marts 2016 af Student015 (Slettet)
Okay :-)
Der står altså 1.7*10^-4Pa :/
Jeg må lige kigge mine enheder igennem så, det var også J/(mol K) jeg kom frem til mht. Cv.
Jeg skal dernæst antage at luften bliver varm, og udvider sig adiabatisk indtil temperaturen falder til T3 = 110K (Jeg havde skrevet T2 til 110 - Der skulle stå 130K)
Hvordan viser jeg, at V3 efter udvidelsen er steget til 2.38m^3 samt udregner hvor stort et arbejde gassen udfører på sine omgivelser under denne adiabatiske proces?
Kender ikke en formel hvor V3 indgår, mht. arbejdet så, så jeg lidt på formlen W=p2V2-p1V1/γ-1
Men jeg kunne ikke komme frem til hvorfra jeg skulle få p2 og gamma, så det er nok ikke rigtigt :/
Svar #9
28. marts 2016 af Heptan
Jeg får Q = 0,000224 J så det er ihvertfald i den størrelsesorden.
#8 Benyt at T2V2γ-1 = T3V3γ-1 for en adiabatisk proces. γ er bare forholdet mellem de to molære varmekapaciteter,
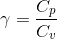
Du har fundet en korrekt formel for arbejdet. Du kender ikke trykket, men du kan beregne den, eller istedet bruge den her formel:
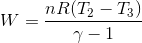
Skriv et svar til: Tilført varme samt entropi - Isobare proces
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.