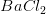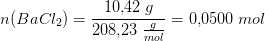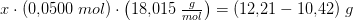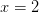Kemi
HJÆLP TIL KEMI
Hej SP
Denne opgave har jeg lidt svært ved:
Krystalvandindholdet i bariumchlorid, BaCl2·xH2O, kan bestemmes ved ophedning af en afvejet mængde af det krystalvandholdige salt. Herved afgives vandetog tilbage bliver det vandfrie salt. Reaktionen skrives:
BaCl2·xH2O(s) ----> BaCl2(s) + x H2O(g)
Ved en øvelse ophedede en elev 12,21 g BaCl2·xH2O. Derpå bestemte eleven¨massen af det vandfrie salt til 10,42 g.
Beregn ud fra resultatet x i formlen for det krystalvandholdige bariumchlorid.
Svar #2
04. september 2016 af Skaljeglavedinelektier
Forskellen mellem de to masser skyldes vandet. Først bestemmes stofmængden af BaCl uden vand:
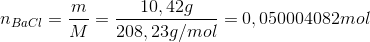
Forskellen mellem de to masser er givet ved:
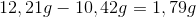
Herved kan du udregne antallet som:
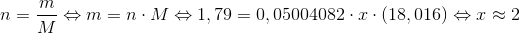
For nemhedens skyld er der ikke indsat enheder - det skal du dog huske. De 18,016 g/mol er vands molarmasse.
Skriv et svar til: HJÆLP TIL KEMI
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.