Kemi
Beregning af stofmængde koncentration af sølvioner og cyannid ioner før reaktionen finder sted hjælp?
30. november 2016 af
tckk
-
Niveau: B-niveau
reaktionen:
Ag^+(aq)+2CN-(aq)<=>Ag(CN)_2-(aq)
K=1,0*10^20M
Der opløses 1,00g sølv(I)nitrat (AgNO_3) og 10,0 g kaliumcyanid ("cyanidkalium", KCN) i så meget vand at den færdige opløsning fylder præcis 1,00L
a) beregn stofmængde koncentrationerne af sølv(I)ioner og cyanidioner før ovenstående reaktion finder sted
b) beregn [Cn-] og [Ag(CN)_2-] i ligevægtsblandingen
tak hvis i kan hjælpe :)
Skriv et svar til: Beregning af stofmængde koncentration af sølvioner og cyannid ioner før reaktionen finder sted hjælp?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.








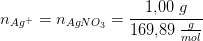
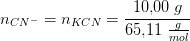 begge i 1 liter.
begge i 1 liter.