Kemi
Reaktionshastighed og kemisk ligevægt
Hej, jeg prøver at kunne forstå nogle af relationerne mellem reaktionshastighed og kemisk ligevægt. Er dette korrekt:
Definitionen på en kemisk ligevægt er at reaktionen kan løbe begge veje med samme reaktionshastighed. Når man laver et indgreb i vægten der bevirker at systemet kommer ud af ligevægt, vil reaktionshastigheden gå hurtigere mod den retning der kan udligne indgrebet så systemet kommer tilbage i ligevægtstilstand (Le Chateliers princip).
Svar #1
27. april 2017 af AngelOneOne
Hej,
le Chateliers princip siger "Et ydre indgreb i et system i ligevægt fremkalder en forskydning, der formindsker virkningen af indgrebet."
Det betyder at et system i ligevægt f.eks.: 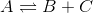 foregår lige hurtigt i begge retninger. Altså hver gang der dannes 1 A forsvinder der 1B og 1C og omvendt. Man siger at et lukket system, altid vil søge mod ligevægt Hvis man så foretager et sådan indgreb der betyder at koncentrationen af A øges, vil systemet søge mod ligevægt igen. Det sker ved at koncentrationerne af B og C stiger. Men for at disse to koncentrationer kan stige, må der opløses noget af A. Denne effekt formindsker virkningen af indgrebet, og det er det som le Chateliers princip forudsiger og ikke noget om reaktionshastigheden hvormed ligevægten indtræffer
foregår lige hurtigt i begge retninger. Altså hver gang der dannes 1 A forsvinder der 1B og 1C og omvendt. Man siger at et lukket system, altid vil søge mod ligevægt Hvis man så foretager et sådan indgreb der betyder at koncentrationen af A øges, vil systemet søge mod ligevægt igen. Det sker ved at koncentrationerne af B og C stiger. Men for at disse to koncentrationer kan stige, må der opløses noget af A. Denne effekt formindsker virkningen af indgrebet, og det er det som le Chateliers princip forudsiger og ikke noget om reaktionshastigheden hvormed ligevægten indtræffer
Selve reaktionshastigheden, siger kun noget om ændringerne i koncentrationerne af reaktanter og produkter per tidsenhed og ikke noget om ligevægten.
Man kan selvfølgelig godt sige, at forskydes ligevægten, vil reaktionen gå modsat af indgrebet, men man kan ikke sige noget om hastigheden, ved blot at vide at der kom mere af A i opløsningen.
/Angel
/Angel
"The Universe is under no obligation to make sense to you" - Niel deGrasse Tyson
“Look deep into nature, and then you will understand everything better” - Albert Einstein
Skriv et svar til: Reaktionshastighed og kemisk ligevægt
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.







