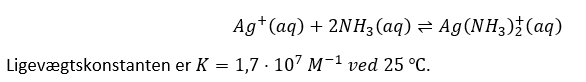Kemi
kemisk ligevægt
10. september 2020 af
andre243g
-
Niveau: B-niveau
Hejsa, jeg er lidt forvirret omkring, hvordan denne opgaves skal løses.
Reaktionsskemaet og ligevægtskonstanten er vedhæftet.
Til en 0,10 M sølv(I)nitrat ledes gassen ammoniak, så [NH3] = 0,20 M ved reaktionens start
a. Beregn ligevægtskoncentrationen af komplekset.
b. Hvor stor en procentdel af sølv(I)ionerne er bundet komplekst i opløsningen?
Vedhæftet fil: Anmærkning 2020-09-10 184329.png
Skriv et svar til: kemisk ligevægt
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.