Kemi
Spørgsmål til en enkelt opgave fra Aug 2015
Hej studieportalen,
jeg sidder med et Kemi A sæt og læser op til eksamen til på torsdag.
Dog er jeg lidt i tvivl om en opgave.
Jeg skal vise at begyndelseskoncentrationen er 0.235M
Jeg har fået opgivet en tabel og et stykke tekst, som jeg har vedhæftet som billeder.
Jeg har forsøgt at opstille en ligning med initialhastigheden, men synes at mangle nogle ubekendte x,y efter det opstillede udtryk. Jeg har derudover også forsøgt at beregne mig frem til dette vha densiteten..
Håber på jeres hjælp :)
Svar #1
31. maj 2016 af Skaljeglavedinelektier
Startvolumen af hydrogenperoxid er 0,00025 L (25 mL). Der er tale om 15 % hydrogenperoxid med en densitet på 1,065 g/ml. Du finder 15 % af de 25 mL, som ganges med densiteten:
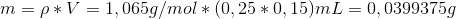
Du kan så beregne stofmængden:
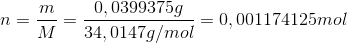
Koncentrationen kan så bestemmes, da du kender volumen af hele opløsningen(for alle stoffer):
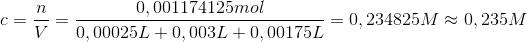
Svar #2
31. maj 2016 af Jollybolly (Slettet)
Tusinde tak, det kan være jeg lige skriver igen senere, da jeg sidder og kæmper med sidste opgave lige nu :)
Svar #3
31. maj 2016 af Skaljeglavedinelektier
Du er velkommen til at skrive. Jeg skal prøve at svare.
Svar #4
01. juni 2016 af Jollybolly (Slettet)
Jeg har et spørgsmål vedrørene den aller sidste opgave hvor man skal udregne hvor meget saltsyre der skal tilsættes opløsningen, mit resultat virker for mig fuldstændig absurd.
Jeg har igen vedhæftet opgaven som billede og mit eget forsøg på en besvarelse
Svar #5
01. juni 2016 af Skaljeglavedinelektier
Bestem stofmængden af hydrogenphosphat ved brug af formlen 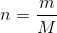 .
.
Det er stofmængden, der er på baseform. Alt er i starten på baseform. Bestem andelen på syreform ved brug af pufferligningen:
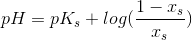
Stofmængden på syreform kan du så finde ved at gange den fundne procentdel med stofmængden af baseformen.
Der tilsættes saltsyre med en koncentration på 0,5 M, hvor reaktionen her sker:
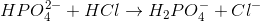
Stofmængden af HCl og H2PO4- vil være ens, da de reagerer i forholdet 1:1. Volumen, der skal tilsættes for at opnå pH 7, kan findes således:
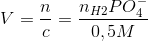
Svar #6
01. juni 2016 af Jollybolly (Slettet)
Tusinde tak for dit hurtige svar :-)
dog får jeg får det samme resultat 1.5*10^-17 L ? Kan det virkelig være rigtigt ?
Svar #7
01. juni 2016 af Skaljeglavedinelektier
Nej kan du skrive, hvordan du beregner det? Smid evt. et billede ind.
Svar #8
01. juni 2016 af Jollybolly (Slettet)
Selvfølgelig da. har smidt et billede ind fra første gang, det ligger i Zip filen. Anden gang #dinmetode har jeg lige vedhæftet her
Svar #9
01. juni 2016 af Skaljeglavedinelektier
Vi har en lille forskel i molarmassen til at starte med.
Ved pufferligningen er pKs 7,21 og ikke -7, som du har skrevet.
Svar #10
01. juni 2016 af Jollybolly (Slettet)
Hvor får du den pKs værdi fra?
Jeg slår op i min Fysik/kemi Databog årgang 2012 under pKs tabellen og ud fra saltsyre (HCL) står der pKs =-7 ? .. Det samme står der i data for uorganiske forbindelser
Svar #11
01. juni 2016 af Skaljeglavedinelektier
Det er rigtig slået op bare for det forkerte stof.
Du skal finde for dihydrogenphosphationen.
Svar #12
01. juni 2016 af Jollybolly (Slettet)
Ahh.. Ja det forklarer jo en helt del, kan se at jeg nu også får det korrekte resultat! Tusinde tusinde tak skal du have for hjælpen :-) !
Skriv et svar til: Spørgsmål til en enkelt opgave fra Aug 2015
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.








