Kemi
Ligevægte - ændring af temperaturen?
Hej alle på SP.
Jeg har problemer med at forklare med udgangspunkt i Le Chataliers princip, hvad der sker i nedenstående ligevægt:
Vi lavede et forsøg, hvor vi betragtede følgende ligevægt:
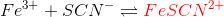
Vi fremstillede en opløsning, hvor vi fyldte 200 mL demineraliseret vand i en 250 mL konisk kolbe og tilsatte 10 mL af 0.1 M Fe(NO3)3 og derefter 10 mL 0.1 M NaSCN.
Vi havde så to reagensglas: det ene anbragte vi i et varmt vandbad, hvor temperaturen var 50 grader Celsius, og det andet i et bægerglas med vand og isterninger (koldt).
Efter forsøgets udfoldelse fandt vi ud af, at opløsningen i det varme vand var blevet lysere, mens opløsningen var blevet "mørkere" i det bægerglas med koldt vand. Men hvorfor sker det nu? Jeg har kigget lidt på det her med endoterme og exoterme reaktioner, men har stadig problemer med at forklare forskydningen med udgangspunkt i Le Chataliers princip.
Kan nogle hjælpe?
Svar #1
29. november 2016 af Mikkeldkdk
Det forsøg med at det ene glas bliver lysere end det andet er fordi at molekylerne trækker sig sammen i et gitter. Kigger du oven fra i glasset vil farverne være fuldstændig identiske.
Svar #2
29. november 2016 af milleneedshelp1 (Slettet)
Nu skulle jeg forklare det ud fra Le Chataliers princip, men er nu meget forvirret. Jeg tror ikke det har noget at gøre med det som du nævner, da vi ikke har snakket om dette i timerne.
Svar #3
29. november 2016 af Soeffi
#2
Hvis reaktionen er exoterm mod højre er den samtidig endoterm mod venstre. Hvis der tilsættes varme, vil reaktionen forskydes i den retning, hvor den er endoterm, så noget af varmen bruges.
Svar #4
29. november 2016 af milleneedshelp1 (Slettet)
#3#2Hvis reaktionen er exoterm mod højre er den samtidig endoterm mod venstre. Hvis der tilsættes varme, vil reaktionen forskydes i den retning, hvor den er endoterm, så noget af varmen bruges.
Men hvorfor bliver opløsningen henholdsvis mørkere og lysere?
Svar #5
29. november 2016 af Soeffi
#4. Det er fordi komplekset på højre side har en farve. Se evt. https://www.youtube.com/watch?v=ZOYyCTvLa9E.
Svar #6
29. november 2016 af milleneedshelp1 (Slettet)
Ja okay - hvordan ændres Kc så ved de to indgreb? Ligevægtskonstanten er jo ved en bestemt temperatur, ikke?
Svar #7
29. november 2016 af Mikkeldkdk
Hvis du ser ovenfra vil farven være tilnærmelsesvis ens, hvorimod at den har en farveændring hvis du kigger fra siden, se vedhætet tegning
Svar #9
29. november 2016 af milleneedshelp1 (Slettet)
Men hvad sker der så i disse to tilfælde med varmt og koldt?
Svar #10
30. november 2016 af Skaljeglavedinelektier
Ved tilført varme vil der ske en forskydning mod venstre. Reaktionen er endotermisk og FeSCN2+ omdannes under forbrug af varmeenergi. Det røde produkt (FeSCN2+) omdannes til den gule og den farveløse reaktant (Fe3+ og SCN-):
Fe3+(aq) + SCN-(aq) <---------- FeSCN2+(aq)
Ved afkøling vil der ske en exotermisk reaktion, hvor der frigøres varme. Der sker en forskydning mod højere, hvilket vil gøre opløsning mørkere grundet mere dannelse af rødt produkt og fjernelse af reaktanterne:
Fe3+(aq) + SCN-(aq) ----------> FeSCN2+(aq)
Mon ikke Johnmat i virkeligheden tænker på to opløsninger (ofte KMnO4) med to forskellige voluminer.
Svar #11
30. november 2016 af Skaljeglavedinelektier
Venstre forskydning vil bevirke en formindskelse af Kc.
Højre forskydning vil bevirke en forøgelse af Kc.
Prøv at se om du kan få det til at give mening.
Svar #12
30. november 2016 af milleneedshelp1 (Slettet)
Det kan jeg ikke helt, hvordan hænger det sammen?
Skriv et svar til: Ligevægte - ændring af temperaturen?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.






