Kemi
syre base
Hej alle
Man siger jo at [H3O+]*[OH-] = 1,0*10^-14 gælder for vand og vandige opløsninger, men jeg forstår ikke hvorfor det også gælder for vandige opløsninger. Hvordan det?
Svar #1
04. december 2016 af FMK
I vandig opløsning, reagere H+ ioner straks med vandmolekyler og danner hydroniumioner, H3O+
Derudover er vand en amfolyt, dvs. den kan både reagere som en syre og som en base.
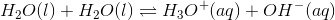 , altså reagere vand i en vis grad med sig selv.
, altså reagere vand i en vis grad med sig selv.
Svar #2
04. december 2016 af pigen12344
Skriv et svar til: syre base
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.



![\left [ OH^- \right ]](https://media.studieportalen.dk/images/equations/u62ObXjly5-lKQYzWwJBXQ==.gif) mindskes med samme faktor som
mindskes med samme faktor som ![\left [ H_3O^+ \right ]](https://media.studieportalen.dk/images/equations/6Fj_WtmFzG5dmkgoP0Rfkg==.gif) øges
øges![\left [ H_3O^+ \right ]_o\cdot k\cdot \left [ OH^- \right ]_o\cdot k^{-1}=\left [ H_3O^+ \right ]_o\cdot \left [ OH^- \right ]_o=10^{-14}\;M^2](https://media.studieportalen.dk/images/equations/Wc30g8aG__5azNzHQNYv-A==.gif)