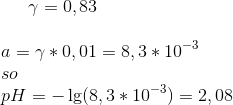Kemi
Stærke syrer
Sidder med den opgave og kan ikke komme i gang.
Calculate the pH of 0.010 M HBr in 0.090 M KBr, using acitvity coefficients (Answer: 2.08)
Svar #3
18. september 2017 af janhaa
#2Hvorfor bruges 0.83 og ikke 0.914 ?
I don't know. Different books and tables, different values?
Svar #4
18. september 2017 af sp2
Jeg forstår ikke hvorfor jeg skal vælge værdien for 0.1 i stedet for værdien for 0.01 (se evt. mit billede)
Svar #5
19. september 2017 af Meteora1 (Slettet)
Hej sp2
Søg svaret på dit spørgsmål på ionestyrke-Wikipedia ( norsk Wikipedia)
Når du regner den samlede ionstyrke ud, får du:
i = 0.5 × ( 0.01×(+1)2 + 0.01×(-1)2 +.09×(+1)2 +.09×(-1)2 )
i = .1 derfor skal du bruge værdien .83
Svar #6
19. september 2017 af Meteora1 (Slettet)
#5
supplering: HBr = H(+1) Br (-1) og KBr = K(+1) Br(-1)
Skriv et svar til: Stærke syrer
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.