Kemi
Syre-base titrering med en stærk syre
Jeg har fået følgende opgave:
En stærk syre (HCl) titreres med en stærk base (NaOH). Der startes med 20 mL titrand. Ved 10,0 mL tilsat 0,1 mol/L NaOH (titrator) er halvdelen af opløsningen neutraliseret.Vis at den aktuelle oxoniumion koncentration er 0,033 mol/L og at pH =1,48 ved 10,0 mL tilsat base.
Tip! Brug titrerreaktionen, tænk på stofmængderegnskabet og volumen regnskabet
Når jeg regner den ud får jeg 0,1 mol/L HCl og eftersom det er en stærk syre er det jo det samme som den aktuelle oxoniumion koncentration.
Hvad gør jeg galt?
Jeg er klar over at jeg har dobbelt så meget syre som base - og at forholdet mellem de 2 er 2:1, men hvad skal jeg ellers bruge?
Svar #1
04. januar 2016 af Toonwire
Hejsa.
Til at starte med har du et volumen på 20 mL (ren saltsyreopløsning)
Så tilsættes der 10 mL 0.1M NaOH hvilket tilsvarer en stofmængde på n(NaOH) = 0.001 mol.
Nu er der så et volumen på 20 mL + 10 mL = 30 mL.
NaOH og HCl neutraliserer hinanden (H + Cl + Na + OH ---> H2O + NaCl)
Dvs. der tilbage i opløsningen er 0.001 mol H+ ioner. n(H+) = n(H3O+) i 30 mL opløsning.
Giver en koncentration på:
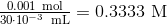
Se nu om du ikke kan klare pH for en stærk syre, husk at disse dissocierer (næsten) fuldstændigt.
Svar #2
04. januar 2016 af Light-Lover (Slettet)
Aaah.
Du fandt min regnefejl. Mange tak.Så kan jeg få afleveret opgaven. Du er simpelthen dagens redning.
Skriv et svar til: Syre-base titrering med en stærk syre
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.









