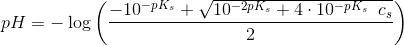Kemi
PH beregning
Benzoesyre har en pks værdi = 4,20
a) Beregn PH i en 0,0010 M opl.
lav pks. så det må være en stræk syre
PH = -log(c(s)) -> PH= -log(0,0010M) -> PH = 3 (stræk syre)
b) Beregn PH i den opløsning som formenner ved blanding af 60 ml 0,0010 M natriumbenzoat med 40 ml 0,0010 M benoesyre.
PH=pks+log([B]/[S]) -> 4,20+log(0,0010M/0,0010) = 4,2
- Tænker at det nok ikke lige er sådan, men hvordan skal jeg beregne PH for 2 blandet væsker? nogen med den begrænsende faktor eller hvordan? Jeg har ikke helt styr på begrænsende faktor i en opløsning?
c) Beregn PH i en 0,010M vandig opløsning natriumbenzoat.
PH = -log(C) -> PH = -log(0,010M) = 2
Skriv et svar til: PH beregning
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.




![\frac{\left [ H_3O^+ \right ]^2}{c_s-\left [ H_3O^+ \right ]}=10^{-pK_s}](https://media.studieportalen.dk/images/equations/-mSFS9H-P2_9xv3hTvav0w==.gif)
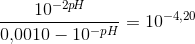
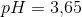
![\frac{\left [ H_3O^+ \right ]^2}{c_s-\left [ H_3O^+ \right ]}=K_s](https://media.studieportalen.dk/images/equations/GwLhyboac_GiNLSB5KMWeg==.gif)
![\left [ H_3O^+ \right ]^2+K_s\left [ H_3O^+ \right ]-K_s\cdot c_s=0\; \; \; \; \; \; \left [ H_3O^+ \right ]>0](https://media.studieportalen.dk/images/equations/bd3Ky0gn5_PlZ9_JGudQIg==.gif)
![\left [ H_3O^+ \right ]=\frac{-K_s+\sqrt{{K_s}^2+4\cdot K_s\; \; c_s}}{2}](https://media.studieportalen.dk/images/equations/3jBq-mxkIn7cec0wZTKFSg==.gif)