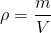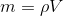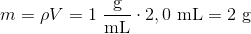Kemi
Syre/base prøve
1) forbrændingen af ethanol har følgende reaktionsskema:
CH3CH2OH + 3O2 = 2CO2 + 3H2O
Beregn massen af vand der dannes, når der forbrændes ti genstande = 120g CH3CH2OH.
M(CH3CH2OH) = 46,07 g/mol og M(H2O) = 18,02 g/mol
2) salmiak fremstilles af saltsyre og ammoniak: HCl (aq) + NH3 (aq) = NH4Cl (aq)
I et forsøg er anvendt 0,100 mol HCl (aq) og 0,080 mol NH3 (aq).
Hvor stor en stofmængde salmiak kan der teoretisk fremstilles?
3) vi vil bestemme, hvor meget eddikesyre (CH3COOH) der er i syltede agurker ved ar titrere med natriumhydroxid-opløsning med phenolphtalein som indikator.
2,0 mL agurkelage overføres med pipette til en lille konisk kolbe. Lidt indikatorpapir tilsættes og med kanylesprøjte tilsættes 0,05 mol/L NaOH
Reaktionen som sker ved titrering er: CH3COOH (aq) + OH- (aq) = CH3COO- (aq) + H2O (l)
a) beregn tilsat stofmængde NaOH
b) vis koncentrationen af CH3COOH i agurkelagen bliver 0,23 mol/L
c) beregn masseprocenten af CH3COOH i agurkelagen, når densiteten af lagen sættes til 1 g/mL og molarmassen for CH3COOH er 60 g/mol
d) ser dit resultat rigtig ud, når der i almindelig husholdningseddike er 5% eddikesyre?
4)
a) beregn pH i 0,012 mol/L HCL (aq)
b) beregn pH i 0,012 mol/L NaOH (aq)
c) beregn [H3O+] i en opløsning med pH = 4,0
d) beregn pH i en blanding af 50mL 0,15 mol/L NaOH (aq) og 100 mL 0,22 mol/L HCL (aq)
(Tip: beregn stofmængder af OH- og H+ og find overskud af en af ionerne. Beregn koncentrationen for den af ionerne der er i overskud. Beregn herefter pH)
Svar #1
08. marts 2016 af mathon
1)
CH3CH2OH + 3 O2 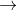 2 CO2 + 3 H2O
2 CO2 + 3 H2O
ækvivalentmængder: 46,07 g 54,06 g
aktuelle mængder: 120 g x
Uner forudsætning af
O2 i overskud:
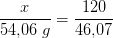
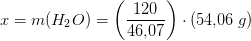
Svar #2
08. marts 2016 af studerendeyo (Slettet)
Svar #3
08. marts 2016 af Heptan
2) Bemærk at alle stofferne er i forholdet 1:1. Der er mindst ammoniak, så det er den begrænsende faktor. Der dannes altså 0,08 mol salmiak.
Svar #4
08. marts 2016 af Heptan
#2 Når man har 1 mol ethanol får man 3 mol vand. Dvs. når man har 46,07 g ethanol får man 54,06 g vand, jf. formlen n = m/M.
Så kan man opstille en ligning til beregning af x, som redegjort i #1.
Svar #5
08. marts 2016 af studerendeyo (Slettet)
18,02g/mol * 3 * 2,6047 = 140,819g, men igen forstår jeg det ikke godt nok til at kunne sige om det er rigtigt, plus at jeg synes det virker som om der mangler nogle udregninger..
Svar #6
08. marts 2016 af Heptan
Din veninde har gjort det rigtigt (men der er vist noget galt med enhederne).
Vi foretrækker at lave én formel og så bruge den til at regne, fordi vi synes det er lettere.
Man skal beregne massen af vand der dannes når 120 g ethanol omdannes. Beregn stofmængden af ethanol der skal omdannes:
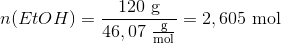
Der står 3 foran H2O i reaktinosskemaet, og der står et usynligt 1 foran CH3CH2OH, så der dannes altså 3 gange mere H2O:
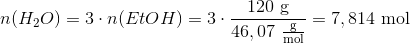
Nu skal vi bare beregne massen med formlen m = nM ...
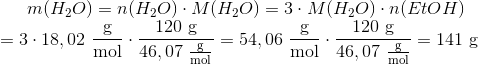
Nu har jeg løst opgaven ad en omvej, men det er måske lettere at forstå. mathon skød en genvej i #1 som er hurtigere, hvis man forstår mængdeberegninger.
Du kan måske se hvor besværligt det er at regne så mange ting ud. Faktisk behøver man kun at bruge den sidste formel jeg har skrevet, og så først sætte tallene ind når man har fundet den sidste formel. Dvs. man skal bare bruge formlen
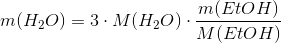
Svar #7
08. marts 2016 af studerendeyo (Slettet)
Tusind, tusind tak! Kan du måske lokkes til at hjælpe med 3 eller 4?
Svar #8
08. marts 2016 af Heptan
3. a) Brug formlen n = cV til at beregne stofmængden.
b) Stofferne reagerer i forholdet 1:1. Brug formlen c = n/V til at beregne koncentrationen. Stofmængden n er den samme som den i a).
c) Beregn massen ethansyre med formlen m = nM hvor n er stofmængden fra a) og M er molarmassen for ethansyre. Beregn massen af agurkelagen, og beregn masseprocenten af ethansyre ved at dividerer massen af ethansyren med massen af agurkelagen. Omregn til procent.
d) Er svaret i c) tæt på 5 %?
Svar #9
08. marts 2016 af studerendeyo (Slettet)
a) n = 0,50 * 0,00092L = 0,00046M
b) 0,00046M : 0,002L = 0,23 mol/L
c) m = 0,00046M * 46,07g/mol = 0,021
Kan ikke rigtig se hvordan jeg skal regne massen af agurkelagen.. Ved ikke rigtig hvad densitet er..
Skriv et svar til: Syre/base prøve
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.