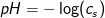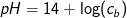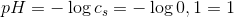Kemi
beregner pH af en stærk syre eller base.
er der nogen der kan forklar mig hvordan man beregner pH af en stærk syre eller base.
Svar #2
10. november 2014 af 1256m (Slettet)
men hvordan regner du den ud. kan du komme med et eksempel. :/
Svar #3
10. november 2014 af LeonhardEuler
Hvis du har en stærk syre i vandig opløsning
HA + H2O → A- + H3O+
vil alt syren omdannes så godt som fuldstændig til sin korreponderende base og derfor ligger denne reaktionen langt til højre. Hervil koncentrationen af den korreponderende base til syren være lig med koncentrationen af det dannede oxonium. Hvorfor den formelle koncentration cs af den stærke syre er lig med den aktuelle koncentration af oxonium. Vandet dissociation spiller en lille rolle og ses bort fra.
Du får da vha. definitionen af pH at pH-værdien er lig med
pH = - log cs
Ligeledes vil du få at pOH for en stærk base i vandig opløsning vil være lig med
pOH = - log cb
og vha. pH + pOH = 14 ⇔ pH = 14 - pOH ⇔ pH = 14 + log cb
Skriv et svar til: beregner pH af en stærk syre eller base.
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.