Kemi
Beregn pH
En opløsning af p-cresol, har en formel koncentration på 0,00850 ?. p-cresols syrestyrkekonstant er 5,50 10-11M ved 25 C.
-Beregn pH:
Reagerer denne syre fuldstændigt, så det bare er -log(H3O+) = Cs og derved pH = -log(H3O+) ?
Svar #1
15. august 2015 af LubDub
Ks = 5,50 • 10-11 M ved 25 oC
pKs = - log(Ks) = -log(5,50 • 10-11) = 10,26
Svar #3
15. august 2015 af LubDub
da pKs-værdien er så høj, er der tale om en meget svag syre
pH = (1/2) • (pKs - log(cs))
Svar #4
15. august 2015 af mathon
man har
for stærke syrer
med pKs < -1,74
![pH=-\log(c_s)=-\log\left(\left [ H_3O^+ \right ]\right)](https://media.studieportalen.dk/images/equations/rQAOhRUj-QiqcvXBQBgYtw==.gif)
for middelstærke syrer
med -1,74 < pKs < 4
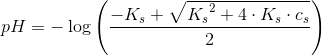
for svage syrer
med pKs > 4
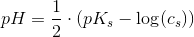
generelt:
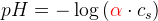 hvor
hvor 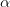 er ioniseringsgraden
er ioniseringsgraden
Svar #5
15. august 2015 af LubDub
for beregning af pH for middelstærke og for svage syrer kan man bruge formlen
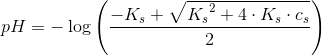
Formlen for beregning af pH af en opløsning af en svag syre er egentligt lidt upræcis, da man, for at komme frem til formlen, antager, at cs - [H3O+] ≈ cs. Jeg har dog ikke regnet på, hvor stor en afvigelse det kan give
Svar #6
15. august 2015 af mathon
For middelstærke og svage monohydrone syrer
ved 25°C:
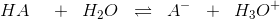
ligevægtskoncentrationer: cs - α·cs α·cs α·cs
ligevægtsbrøk
![\frac{\left [ H_3O^+ \right ]^2}{c_s-\left[ H_3O^+ \right ]}=K_s](https://media.studieportalen.dk/images/equations/gsGfY5F__mXpSnJZqk0fNA==.gif)
Hvis pH kun regnes med én decimal og ![\alpha \cdot c_s=\left [ H_3O^+ \right ]<<0,05\cdot c_s](https://media.studieportalen.dk/images/equations/s_jL_3jA0hkwcYHRVGe79A==.gif)
kan
![\frac{\left [ H_3O^+ \right ]^2}{c_s-\left[ H_3O^+ \right ]}=K_s](https://media.studieportalen.dk/images/equations/gsGfY5F__mXpSnJZqk0fNA==.gif) approksimeres til
approksimeres til ![\frac{\left [ H_3O^+ \right ]^2}{c_s}=K_s](https://media.studieportalen.dk/images/equations/5P_M3ElL9K4lTI8jHUQOXw==.gif)
hvoraf
![\left [ H_3O^+ \right ]^2=K_s\cdot c_s](https://media.studieportalen.dk/images/equations/-9sr4vgClcuDw62WMTPx5g==.gif)
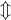
![2\cdot \log\left ( \left [ H_3O^+ \right ] \right )=\log(K_s)+\log(c_s)](https://media.studieportalen.dk/images/equations/UPx2Y0N5WVfriqpQT52Xag==.gif)
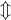
![\log\left ( \left [ H_3O^+ \right ] \right )=\frac{1}{2}\left (\log(K_s)+\log(c_s) \right )](https://media.studieportalen.dk/images/equations/3Th99dWOVXq7UCJNiv0OBw==.gif)
![-\log\left ( \left [ H_3O^+ \right ] \right )=\frac{1}{2}\left (-\log(K_s)-\log(c_s) \right )](https://media.studieportalen.dk/images/equations/fnOgarEyR8v2GeFoNsFKpQ==.gif)
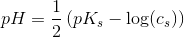
Svar #7
16. august 2015 af Heptan
#0 og #4
Man har
for svage syrer
at 4 < pKs < 10
og for meget svage syrer
at 10 < pKs < 15,74
Jf. #5 er det ikke umiddelbart rimeligt at bruge formlen for svage syrer, da syren derimod er meget svag. Det skyldes dog ikke antagelsen cs - [H3O+] ≈ cs da dette stadig er en god antagelse, og den bliver bedre jo større pKs er. Derimod har formlen "ikke-stærk syre" og formlen "svag syre" den her urimelige
antagelse [A-] >> [OH-]. Inddrages vands ionprodukt fås pH med 3 betydende decimaler og formlen
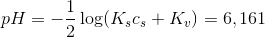
Bruger man derimod formlen for svage syrer kan resultatet angives med 1 betydende decimal, idet
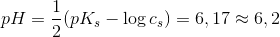
Skriv et svar til: Beregn pH
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.


