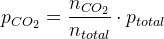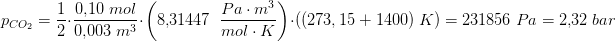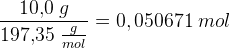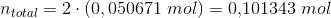Kemi
beregning af tryk
Hej Jeg har denne opgave:
ved opvarming til 1360 grader omdannes BaCO3 (g), til BaO (g) og CO2 (g).
10.0 gram BaCO3 (g) opvarmes til 1400 grader i en luft tom beholder på 3.0L
Beregn trykket af CO2 (g) i beholderen ved 1400 grader.
første skridt er vel at finde ud af hvor mange gram CO2 der blir omdannet..
massen på BaCO3 (g) ved start er vel 10.0 gram..
-Skal jeg nu finde stofmængden, er det en redox, eller hvor skal jeg nu gå hen for at komme videre?
På forhånd tak
Svar #1
15. september 2015 af mathon
Beregn antal mol CO2 (g) og antal mol BaO (g), der dannes af 10,0 g BaCO3 (g) ved 1400°C.
n(CO2)
p(CO2) = ---------- · ptotal
ntotal
Partialtrykket er molbrøken af totaltrykket.
Svar #2
15. september 2015 af GalVidenskabsmand (Slettet)
BaCO3 (g) --> BaO (g) + CO2 (g)
n(BaCO3) = 10,0 g / (197.3359 g/mol) = 0,050675 mol
I følge reaktionsligningen bliver der dannet 1 mol CO2 for hvert mol BaCO3, så
n(CO2) = 0,050675 mol
Så er det bare at anvende idealgasligningen.
pCO2*V = n(CO2)RT
Svar #3
15. september 2015 af Flade (Slettet)
n(CO2)= X / (44.01 g mol-1)
ntotal (n BaCO3 (g)?)= 197.311g mol-1
er det på rette vej?
Svar #4
15. september 2015 af Flade (Slettet)
#2BaCO3 (g) --> BaO (g) + CO2 (g)
n(BaCO3) = 10,0 g / (197.3359 g/mol) = 0,050675 mol
I følge reaktionsligningen bliver der dannet 1 mol CO2 for hvert mol BaCO3, så
n(CO2) = 0,050675 mol
Så er det bare at anvende idealgasligningen.
pCO2*V = n(CO2)RT
Der bliver dannet et mol CO2 for hvert mol BaCO3..
Bliver der også dannet et mol BaO for hvert mol BaCO3? Bare for at forstå det helt?
Svar #5
15. september 2015 af GalVidenskabsmand (Slettet)
Ja.
Der er 0,050675 mol BaCO3 til at starte med. Dette bliver så omdannet til 0,050675 mol BaO og 0,050675 mol CO2.
Svar #6
15. september 2015 af Flade (Slettet)
#5Ja.
Der er 0,050675 mol BaCO3 til at starte med. Dette bliver så omdannet til 0,050675 mol BaO og 0,050675 mol CO2.
Tak!!
Jeg tygger lige videre på den, men måske er den i mål :-)
Svar #8
15. september 2015 af Flade (Slettet)
#6#5Ja.
Der er 0,050675 mol BaCO3 til at starte med. Dette bliver så omdannet til 0,050675 mol BaO og 0,050675 mol CO2.
Tak!!Jeg tygger lige videre på den, men måske er den i mål :-)
pCO2= ( 0.050675mol * 8.3145J*K-1*mol-1 * 1400 grader C ) / 3.0L
pCO2= 196.624 bar...
men J.F. facit så burde jeg få det til 2.35 bar.. Hmm hvad glemmer jeg?
Svar #9
15. september 2015 af GalVidenskabsmand (Slettet)
T er temperaturen i K, så T = 1400 + 273K
Du skal regne de 3,0 L om til m3.
Du får så resultatet ud i Pa. Hvis du vil regne det om til bar, skal du benytte, at 1 bar = 100.000 Pa.
Svar #12
15. september 2015 af Flade (Slettet)
#9T er temperaturen i K, så T = 1400 + 273K
Du skal regne de 3,0 L om til m3.
Du får så resultatet ud i Pa. Hvis du vil regne det om til bar, skal du benytte, at 1 bar = 100.000 Pa.
Takker mange gange
Svar #13
15. september 2015 af Flade (Slettet)
#7
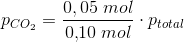
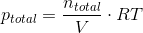
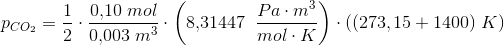
Kan godt se at du når i mål; Men hvor kommer den 1/2 fra, & hvordan får man ntotal til o,10 mol?
Svar #16
15. september 2015 af Flade (Slettet)
#14#13
egentlig
bliver til
og
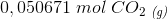
ntotal=2 * (0.050671 mol) fordi det er produkterne lagt sammen? :-)
Skriv et svar til: beregning af tryk
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.