Kemi
Syrebase - nemt!
Jeg har virkeligt svært ved kemi og læser pt. hjemmefra, så har en masse dumme spørgsmål.
Fx. hvorfor danner baser OH-? Er det fordi en base defineres som et stof der kan optage en H+, hydron, og den hydron tager den fra vand, derfor bliver alt vandet til OH- hvis det er en stærk base, fordi H2O "mister" et H?
Og omvendt defineres en syre, som et stof der kan afgive en hydron. Vil en syre så altid give H3O i en reaktion med vand, fordi den afgiver en hydron til vandet? Og hvis det så er en svag syge som ikke omdanner al vandet, vil man så få produkter efter reaktionspilen som både H2O og H3O?
Håber det giver mening!
Svar #1
02. juni 2017 af ChemistryIsKey
Du har helt ret i det du skriver! Du kan lave generelle reaktionsligninger for syrers og basers reaktion med vand;
Syrer: HS + H2O --> S- + H3O+ (Hvor S- er den korresponderende base til syren HS)
Baser: B + H2O --> BH+ + OH- (Hvor BH+ er den korresponderende syre til basen B)
Det eneste der er lidt problemer med er, at man ikke får H2O som produkt, hvis syren/basen er svag, men derimod vil det 'bare' være en reaktant som ikke har reageret :)
Svar #2
03. juni 2017 af NannaJan
Tusinde tak for svar!
Hvad så hvis syrer ikke reagerer med vand men i andre stoffer som ikke nødvendigvis indeholder hydrogen eller oxygen? Vil der så stadigvæk altid blive skabt H3O+ og OH-? Jeg ved ikke om det spørgsmål overhovedet giver mening.
Og vil en syre så altid danne base? For I dit 1. eksempel reager vandet vel som en base og bliver til H3O+ fordi den optager en hydron? Men hvis S- også er en base, så kan det jo ikke passe? Altså jeg prøver virkeligt at forstå det her :D
Svar #3
03. juni 2017 af NannaJan
Og!
En hydron kan ikke eksistere frit, der er altså nødt til at være en base tilstede som kan optage denne, før en syre kan reagere som en syre. Er det derfor en beholder med noget syre i pulverform (går jeg ud fra findes?) ikke reagerer, men så snart det kommer på ens hud kan det ætse, fordi den består af vand?
Svar #4
03. juni 2017 af mathon
Du skal tage syrestyrken i betragtning. H2O er en yderst svag syre.
Hvis HS er en stærk syre, er S- en yderst svag base.
Hvis HS er en middelstærk syre, er S- en meget svag base.
Hvis HS er en svag syre, er S- en svag base.
stærk syre: 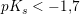
middelstærk syre: 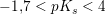
svag syre: 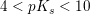
meget svag syre: 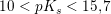
yderst svag syre: 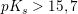
Svar #5
03. juni 2017 af NannaJan
Fx. NH3 ammoniak er en svag base, ikke? Opløser vi det i vand får vi ammoniumion NH4+ som er svag syre og den stærke base OH-.
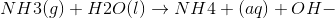
Men så går det helt galt for mig og logikken. For hvis en base danner en syre, hvorrfor afgiver syren så ikke hydronen igen? Altså der må være en eller anden form for ping-pong med den hydron, hvorfor kan det ikke bare gå tilbage til at være NH3 igen?
Svar #6
03. juni 2017 af NannaJan
Er det så fordi man skal se på forholdet mellem NH4+ og OH-? At hvis man i teorien skulle sætte procent på, så ville det være 10% NH4+ og 90% OH--agtigt?
Svar #7
03. juni 2017 af mathon
For ikke stærke syrer:
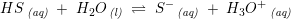
ligevægtskonc. (1 - α)·cs α·cs α·cs
syrekonstanten 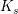 og koncentrationen
og koncentrationen 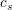 har betydning for dissociationsgraden
har betydning for dissociationsgraden 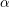 :
:
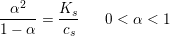
Svar #8
03. juni 2017 af mathon
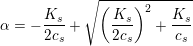
Hvorfor det ikke forholder sig, som du siger:
"Når syren har fraspaltet protonen, vil den korresponderende base straks genoptage protonen"
Der indstiller sig en ligevægt afhængig af styrkeforhold og koncentrationer.
Skriv et svar til: Syrebase - nemt!
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.





