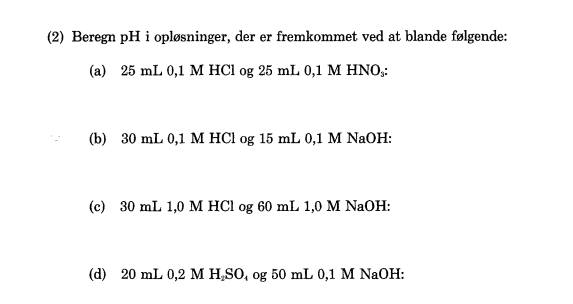
Kemi
opgave 2 syre base beregninger hjælp
24. oktober 2021 af
Sofia0294
-
Niveau: B-niveau
Hej allesammen, er der nogle der kan hjælpe mig med denne opgave? har siddet og beregnet med forstår det ikke. Nogle der også kan sende formler på hvordan jeg beregner?
Tak på forhånd.
Vedhæftet fil: opgave 2.png
Skriv et svar til: opgave 2 syre base beregninger hjælp
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.