Kemi
Reaktionshastigheden for reaktionen?
N2 +3H2 ----2NH3
Er ved forsøg blevet målt til -(H2)/ t = 2, 50 x 10^-4( dette udtrykker hvor meget H2 der omdannes pr sekund)
Hvor stor er reaktionshastigheden udtryk ved:
a) Fald i koncentrationen N2?
b) Stigning i koncentration af NH3?
Mange 1000 tak . Håber i kan hjælpe trin for trin da jeg først lige er ved at lære det:)
Svar #2
15. april 2016 af HFNU (Slettet)
Undskyld jeg er virkelig helt ny til det her og er først ved at forstå hvad :
ΔH= H (produkter)- H (reaktanter) betyder. Når man så siger H2 eller -H2 hvad betyder det så helt præcist? er det så hvor meget Enthalpi der er i reaktionen??
Svar #3
15. april 2016 af mathon
Koncentrationsændringen for reaktanterne er negativ,
hvorfor
![v=-\frac{\mathrm{d} \left [ H_2 \right ]}{\mathrm{d} t}](https://media.studieportalen.dk/images/equations/bhHqE-Yf0Kjifw1K3JNTfQ==.gif) er positiv
er positiv
Koncentrationsændringen for produktet er positiv,
hvorfor
![v=\frac{\mathrm{d} \left [ NH_3 \right ]}{\mathrm{d} t}](https://media.studieportalen.dk/images/equations/udEWLRn2S2Ni6LiCT8T0dw==.gif) er positiv
er positiv
som intet har med enthalpi at gøre.
Svar #4
15. april 2016 af HFNU (Slettet)
Ok har lige læst det igen . I min bog står der at Enthalpitilvæksten for en kemisk reaktion er forskellen i den samlede enthalpi for henholdsvis reaktanterne og produkterne, og den kan derfor udregnes som:
ΔH = H(produkter) -H (reaktanter)
hvorfor siger man så - H2? er det så fordi det er en exoterm reaktion? hvad betyder det når du : Ganger 2,50 x 10 ^-4 mol med L^-1x S^-1?
Svar #6
15. april 2016 af HFNU (Slettet)
ja super :) det er målenheden for reaktionshastigheden. Men forstår slet ikke det med H2....har læst dit svar nr 3 -3 gange nu .
Svar #7
15. april 2016 af HFNU (Slettet)
Betyder H2 koncentrationsændring?
og hvis den er -H2 er koncentrationsændringen positiv for de to stoffer N2 og 3H2?
Svar #9
15. april 2016 af HFNU (Slettet)
Jeg har nu prøvet at kigge dette link med nogenlunde samme opgave https://www.studieportalen.dk/forums/Thread.aspx?id=1371979
og her står der at N2 falder 1/3 hurtigt, mens NH3 stiger 2/3. Det er pågrund af kofficienterne 2NH3, I 2NH3 er der 1 N2, men 2 NH3. Derfor skal de divideres med 1/3 når det er N2 og divider med 2/3 dele når det er 2NH3.
Resultatet bliver som du også har hjulpet med at 1/3 og 2/3 skal ganges med den angivet reaktionsenhed i M/s :
a) omdannelsen af N2: (1/3) • v = (1/3) • (2,5·10-4 M/s) = 8,3·10-5 M/s
b) dannelsen af NH3: (2/3) • v = (2/3) • (2,5·10-4 M/s) = 1,7·10-4 M/s
Sidder virkelig fast i det- så håber i kan hjælpe.
Det første er når jeg regner a)N2. Får jeg : 0.000083333? og ikke 8,3. Hvordan kommer man frem til 8,3 og og 10^-5 M/s
Er det resultatet?
Svar #11
16. april 2016 af HFNU (Slettet)
Tak ja jeg har prøvet at sige: 8,3 x 10^-5 M/s og ved at det er det samme som 0.000083333.
Men forstår bare ikke hvordan man ved man skal skrive det som 8,3·10-5 M/s..
Har kigget på de kemiske formler og regler osv men desværre har jeg stadig ikke kunne finde svaret der:(
Skriv et svar til: Reaktionshastigheden for reaktionen?
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.








![v=-\frac{\mathrm{d} \left [ H_2 \right ]}{\mathrm{d} t}=2{,}50\cdot 10^{-4}\; mol\cdot L^{-1}\cdot s^ {-1}](https://media.studieportalen.dk/images/equations/Ce32NwJtqZ4wKpq1JbUr6A==.gif)
![-\frac{\mathrm{d} \left [ N_2 \right ]}{\mathrm{d} t}=\frac{1}{3}\cdot\left ( -\frac{\mathrm{d} \left [ H_2 \right ]}{\mathrm{d} t} \right )](https://media.studieportalen.dk/images/equations/x7U984ae9PyrLKzu5WWbNg==.gif)
![\frac{\mathrm{d} \left [ NH_3 \right ]}{\mathrm{d} t}=\frac{2}{3}\cdot \left ( -\frac{\mathrm{d} \left [ H_2 \right ]}{\mathrm{d} t} \right )](https://media.studieportalen.dk/images/equations/v3okKeVpb-xqRt87XoHpJw==.gif)
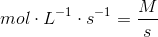 hvor
hvor 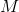 er molariteten
er molariteten