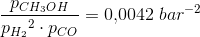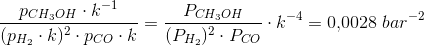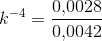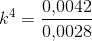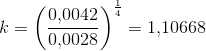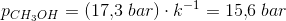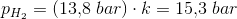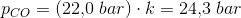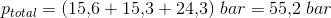Kemi
Tryk i en beholder
Hej
Jeg har fået stillet den opgave, at jeg skal beregne trykket i en beholder efter en temperaturstigning.
Der kigges på denne reaktion: 2H2 (g) + CO (g) --> CH3OH (g)
Jeg ved følgende:
Før opvarmningen var partialtrykkene og totaltrykket:
p(H2): 13.8 bar
p(CH3OH): 17.3 bar
p(CO): 22 bar
p(total): 53.1 bar
Ligevægtskonstanten er da 0.0042 bar2
Efter opvarmningen (de specifikke temperaturer er ikke oplyst) er ligevægtskonstanten på 0.0028 bar-2
Jeg skal altså herudfra kunne beregne partialtrykkene og totaltrykket, hvilket jeg har problemer med:
Mit bud er, at den første reaktionsbrøk på en eller anden måde kommer i spil: K = 17.3 bar/((13.8 bar)2*22bar)
Hvordan løser jeg opgaven?
Skriv et svar til: Tryk i en beholder
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.