Kemi
Spørgsmål til redox og pH-beregning
Spørgsmål til redox
Hvilken sammenhæng er der mellem stoffers opbygning og oxidationstal? Jeg er ikke helt med på hvad der forventes af svar.
Spørgsmål til pH
Hvilke antagelser gør man når man skal beregne pH-værdien for henholdsvis en middelstærk og svag syre?
Tak på forhånd. :)
Svar #1
02. juni 2016 af umolich
Redox:
Måske er det noget idenne retning de spørger til:


Altså man kan sige at oxidationstrinnet for svovl i SO32- er +4 fordi den bruger 4 elektron til at lave bindinger til oxygen, mens de sidste to af dens valenselektroner ikke bruges til binding ("lone pair"). På samme måde er oxidationstrinnet +6 i SO42- fordi alle 6 valenselektroner bliver brugt til bindinger. Oxidationstal er altså et udtryk for hvor mange valenselektroner der bruges/afgives til bindinger - Mn2+ er jo f.eks. ikke i en binding, men har afgivet to elektroner til et andet stof, som f.eks.:
MnCl2 --> Mn2+ (aq) + 2 Cl- (aq)
Svar #2
02. juni 2016 af umolich
Med hensyn til pH kan det være noget med vandsautoprotolyse man ser bort fra, fordi mængden af syre der bliver dannet herved typisk er forsvindende lille i forhold til den middelstærke eller svage syre man regner på.
Jeg kan ikke lige nu og her komme på nogle andre antagelser "man" gør - der er nogle der fjerner x'et fra nævneren i ligningen:
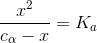
men det ville jeg ikke nævne som en generel ting. Der er sikkert noget andet jeg har glemt, det kan være nogle andre her på forummet kan komme på det.
Skriv et svar til: Spørgsmål til redox og pH-beregning
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.








