Kemi
Hjælp til besvarelse med spørgsmål om orbiatler
Hvilken information om orbitalerne i et hydrogenatom fås fra kvantetallene n,l og m?
Hvorledes adskiller 2s og 3s orbitaler sig fra hinanden?
Opskriv følgende orbitaler i et heliumatom efter stigende energi, 2p, 5f, 5d, 2s
Hvordan gøres alt dette?
Svar #1
18. september 2017 af ChemistryIsKey
Der er en frygtelig masse teori bag orbitaler, men forenklet kan du sige, at
n er hovedkvantetallet som angiver hvilket energiniveau/hvilken elektronskal man befinder sig i (n ≥ 1).
l er det angulære kvantetal som angiver 'formen' af orbitalen. Du bør huske, at l = 0 er en s-orbital, l = 1 er en p-orbital, l = 2 er en d-orbital og l = 3 er en f-orbital. Disse orbitaler er vigtigst i praksis, men man kan i princippet fortsætte, så l = 4 er en g-orbital, l = 5 er en h-orbital osv. osv. (Husk, at l = {n-1, n-2, n-3, ... ,0}).
ml er det magnetiske kvantetal, som angiver den rummelige udstrækning af orbitalerne. Du bør huske, at ml = {-l, -l+1, -l+2, ... , 0, ... , l-2, l-1, l}. Et godt eksempel er p-orbitaler. Du ved, at der er tre p-orbitaler pr. elektronskal og disse står vinkelret på hinanden i hver sin retning i et tredimensionelt koordinatsystem, så du har px, py og pz. ml anvendes til at skelne mellem disse tre orbitaler, alt efter hvilken rummelig udstrækning de har, se herunder;
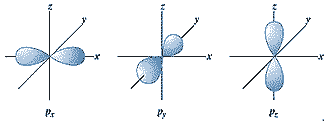
Et eksempel på hvordan du bruger kvantetallene er herunder;
Antag, at vi skal placere én elektron i en orbital, svarende til energiniveauet n = 3. Vi ønsker at undersøge, hvilke orbitaler vi kan placere den i.
Da vi har n = 3, må der gælde, at l = {2, 1, 0}. Disse værdier for l afslører, at der er tre typer af orbitaler i dette energiniveau, nemlig s-orbitalen (l = 0), p-orbitalerne (l = 1) og d-orbitalerne (l = 2).
Nu har vi fundet l, så lad os fortsætte til at finde ml for hver værdi af l.For l = 0 har vi ml = 0, svarende til den ene 5s-orbital der er i energiniveauet (5s orbitalen).
For l = 1 har vi ml = {-1, 0, 1}, svarende til de tre 5p-orbitaler i energiniveauet (5px, 5py, 5pz).
For l = 2 har vi ml = {-2, -1, 0, 1, 2}, svarende til de fem 5d-orbitaler i energiniveauet.
Det ses nu, at vi har mange muligheder for at placere elektronen; 1 s + 3 p + 5 d = 9 orbitaler i energiniveauet, hvor vi kan placere elektronen.
(HUSK dog: Dette er kun et eksempel. Hvis vi skulle placere elektronen, skulle vi gøre det sådan, at vi placerede den i orbitalen med mindst energi, svarende til 5s orbitalen = Aufbau princippet!)
Til dine andre spørgsmål;
En 2s og 3s orbital adskiller sig kun fra hinanden mht. hovedkvantetallet n, svarende til at 3s orbitalen er i et højere energiniveau end 2s orbitalen. De er begge sfærisk symmetriske, så de har samme form og udstrækning (l og ml) er ens.
Efter stigende energi;
2s < 2p < 5d < 5f
Forklaringen er, at jo højere hovedkvantetallet n er, jo højere er energiniveauet og således må orbitalens energi også være højere. Der gælder også, at jo højere det angulære kvantetal l er, jo højere er orbitalen også i energi (forklaringen på dette er orbitalernes udstrækning og hvor tæt elektronerne er på kernen, hvilket er favorabelt).
Håber det hjælper :)
Skriv et svar til: Hjælp til besvarelse med spørgsmål om orbiatler
Du skal være logget ind, for at skrive et svar til dette spørgsmål. Klik her for at logge ind.
Har du ikke en bruger på Studieportalen.dk?
Klik her for at oprette en bruger.








